题目内容
常温下pH=a的CH3COOH稀溶液与pH=b的NaOH稀溶液等体积混合,下列判断正确的是
| A.反应过程中,CH3COOH的电离程度增大 |
| B.若a+b=14,则混合后pH=7 |
| C.若混合后pH=5.3,则c(Na+)< c( CH3COO-) |
| D.若混合后CH3COOH与NaOH恰好完全反应,则混合前a+b<14 |
AC
试题分析:醋酸是弱酸,加入NaOH溶液,发生酸碱中和反应,减小溶液中氢离子浓度,使CH3OOH
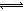 CH3COO—+H+的平衡右移,促进醋酸的电离,故A选项正确;若a+b=14,则混合前醋酸稀溶液中氢离子的物质的量等于NaOH稀溶液中氢氧根离子的物质的量,但是NaOH是完全电离的强碱,不可能再电离出氢氧根离子,而醋酸是弱酸,发生酸碱中和反应导致醋酸稀溶液继续电离出氢离子,则氢离子过量,氢氧根离子不足,所以混合溶液一定呈酸性,pH<7,故B选项错误;无论醋酸与NaOH的量的多少,混合溶液中只含有Na+、H+、CH3COO—、OH—,遵循电荷守恒原理,即c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),若混合后pH=5.3,则混合后溶液呈酸性,c(H+)> c(OH-),因此可以推导出溶液中c(Na+)<c(CH3COO-),故C选项正确;若混合后CH3COOH与NaOH恰好完全反应,则CH3COOH+NaOH= CH3OONa+H2O,则CH3COOH与NaOH的物质的量浓度一定相等,设它们都是0.01mol/L,则前者的pH>2,后者的pH=12,即混合前两种溶液的pH之和大于14,故D选项错误。
CH3COO—+H+的平衡右移,促进醋酸的电离,故A选项正确;若a+b=14,则混合前醋酸稀溶液中氢离子的物质的量等于NaOH稀溶液中氢氧根离子的物质的量,但是NaOH是完全电离的强碱,不可能再电离出氢氧根离子,而醋酸是弱酸,发生酸碱中和反应导致醋酸稀溶液继续电离出氢离子,则氢离子过量,氢氧根离子不足,所以混合溶液一定呈酸性,pH<7,故B选项错误;无论醋酸与NaOH的量的多少,混合溶液中只含有Na+、H+、CH3COO—、OH—,遵循电荷守恒原理,即c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),若混合后pH=5.3,则混合后溶液呈酸性,c(H+)> c(OH-),因此可以推导出溶液中c(Na+)<c(CH3COO-),故C选项正确;若混合后CH3COOH与NaOH恰好完全反应,则CH3COOH+NaOH= CH3OONa+H2O,则CH3COOH与NaOH的物质的量浓度一定相等,设它们都是0.01mol/L,则前者的pH>2,后者的pH=12,即混合前两种溶液的pH之和大于14,故D选项错误。
练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 CH3COO- +H+下列说法正确的是( )
CH3COO- +H+下列说法正确的是( )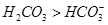 ,碱性
,碱性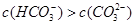
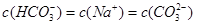
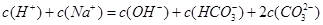
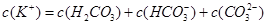
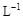 醋酸溶液加水稀释,下列说法正确的是()
醋酸溶液加水稀释,下列说法正确的是()