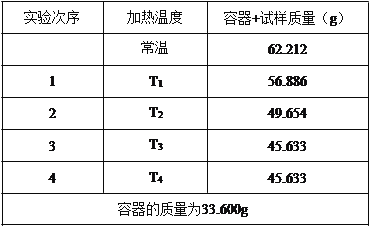
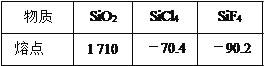题目内容
【题目】实验室用下图所示的装置制取乙酸乙酯。
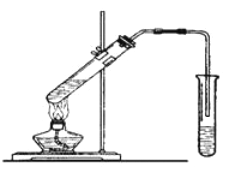
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,操作步骤如下: _________________________,然后轻振荡使其混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是 _______________________________________________。
(3)浓硫酸的作用是:① _______________; ② ______________。
(4)图中右边试管中试剂是 _____________________________。
(5)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式______________________________________
(7)写出乙酸与碳酸氢钠反应方程式_______________________________________________
【答案】 向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸 挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减少引起倒吸 催化剂 吸水剂 饱和碳酸钠溶液 分液 分液漏斗,烧杯 CH3COOH+CH3CH218OH ![]() CH3CO18OCH2CH3 + H2O CH3COOH + NaHCO3 === CH3COONa + CO2 ↑ + H2O
CH3CO18OCH2CH3 + H2O CH3COOH + NaHCO3 === CH3COONa + CO2 ↑ + H2O
【解析】(1)制取乙醇、乙酸和浓硫酸的混合液时,正确操作方法为:向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸,故答案为:向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸;
(2)乙醇和乙酸的沸点较低,反应过程中容易挥发,由于挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减小引起倒吸现象,故答案为:挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减小引起倒吸;
(3)浓硫酸在乙酸乙酯的制取反应中,能够加快反应速率,起到了催化剂作用,能够吸收反应生成的水,通过了乙酸乙酯的产率,起到了吸水剂的作用,故答案为:催化剂;吸水剂;
(4)乙酸乙酯在饱和碳酸钠溶液中溶解度减小,且饱和碳酸钠溶液能够吸收挥发出来的乙酸和乙醇,所以吸收乙酸乙酯使用的是饱和碳酸钠溶液,故答案为:饱和碳酸钠溶液;
(5)乙酸乙酯不溶于饱和碳酸钠溶液,所以混合液分层,可以通过分液操作将乙酸乙酯分离出来;分液操作使用的仪器有分液漏斗、烧杯等,故答案为:分液;分液漏斗、烧杯;
(6)乙酸与乙醇生成乙酸乙酯的反应中,乙醇脱去羟基中的氢原子、乙酸脱去羧基中的羟基,所以18O反应后进入乙酸乙酯中,该反应的化学方程式为CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O,故答案为:CH3COOH+CH3CH218OH
CH3CO18OCH2CH3+H2O,故答案为:CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O;
CH3CO18OCH2CH3+H2O;
(7)乙酸与碳酸氢钠反应生成乙酸钠、二氧化碳和水,反应的化学方程式为CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O,故答案为:CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O。

【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
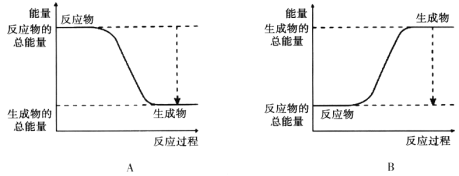
(2)下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。