题目内容
1.胆矾CuSO4•5H2O可写成[Cu(H2O)4 ]SO4•H2O,其结构示意图如下:
下列说法正确的是( )
| A. | 在上述结构示意图中,所有氧原子都采用sp3 杂化 | |
| B. | 在上述结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
分析 根据结构示意图中氧原子是否都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析.
解答 解:A.氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同.从现代物质结构理论出发,硫酸根离子中S和非羟基O之间除了形成1个σ键之外,还形成了反馈π键.形成π键的电子不能处于杂化轨道上,O必须保留未经杂化的p轨道,就不可能都是sp3杂化,故A错误;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故B正确;
C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,故D正确;
故选:BD.
点评 本题主要考查分子间作用力、杂化轨道、化学键类型等知识,注重了对物质结构中常考考点的综合,题目难度中等.

练习册系列答案
相关题目
16. 常温下0.lmol•L-1的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.lmol•L-1的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
 常温下0.lmol•L-1的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.lmol•L-1的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A为二元弱酸,其电离方程式为:H2A?H++HA-、HA-?H++A2- | |
| B. | 在0.lmol•L-1NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 在pH=1.2时,向H2A溶液中加入一定体积的0.lmo l•L-1的NaOH溶液使pH=4.2,则c(A2-)、c(HA-)、c(H2A)之和不变 | |
| D. | 在 pH=3.0 时:c(A2-)+c(HA-)<0.lmo l•L-1 |
16.下列实验操作不能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 除去淀粉溶液中的NaCl | 将混合物装入半透袋中,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有的A1粉 | 加足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗正口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
6.如图为原电池示意图,下列说法正确的是( )


| A. | 该装置能够将化学能转化成电能 | B. | 锌是负极,发生还原反应 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 铜是负极,发生氧化反应 |
13.下列有关化学用语正确的是( )
| A. | HCl的电子式为: | B. | Cl-的结构示意图为: | ||
| C. | CO2的电子式: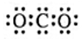 | D. | 乙烯的结构简式是CH2CH2 |
10.在K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2中的一或两种杂质.将13.8g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0g沉淀,则原样品中含有的杂质会是( )
| A. | 肯定含有KNO3,没有Ba(NO3)2;可能含有Na2CO3 | |
| B. | 肯定含有Na2CO3,没有Ba(NO3)2 | |
| C. | 肯定没有Na2CO3,Ba(NO3)2 | |
| D. | 无法判断含何种杂质 |
11.在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5mol/(L•s) | B. | v(B)=0.3mol/(L•s) | C. | v(c)=0.8 mol/(L•s) | D. | v(D)=30mol/(L•min) |