题目内容
在773 K,体积为V L的恒温恒容的容器中,硫和氧气可以发生如下转化,其反应过程和能量的关系如图1所示。其中状态III为平衡状态。

已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
请回答下列问题:
(1)写出表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)在另一个温度和容积相同的容器中,1 mol SO2和2 mol O2充分反应,放出的热量比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)恒容条件下,对状态III采取下列措施,能使n(SO3)/n(SO2)增大的有 。
A.降低温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g) D.使用催化剂
(5)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 。
(6)图2中表示平衡混合物中SO3的含量最高的一段时间是 。
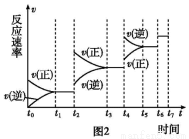
A. t1~t2 B. t3~t4 C. t5~t6 D. t6~t7
练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目


 CO2(g) + N2(g),平衡时c(NO)随温度T的变化如下图所示,则下列说法正确的是( )
CO2(g) + N2(g),平衡时c(NO)随温度T的变化如下图所示,则下列说法正确的是( )
 mol-1 C.
mol-1 C.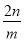 mol-1 D.n mol-1
mol-1 D.n mol-1