题目内容
二氧化氯(ClO2,黄绿色气体)是一种比Cl2更为理想的饮用水消毒剂,世界卫生组织(WHO)将其定为1A级安全消毒剂。用Cl2作自来水的消毒剂可能导致对人体的损害,其原因是水源中所含的某些杂质特别是有机物可能与Cl2产生致癌物质。目前生产ClO2的方法有多种,其中之一是用NaClO3、Na2SO3、浓硫酸反应。(1)请写出其化学方程式:___________________________________。
(2)采用二氧化氯(ClO2)对自来水消毒的优点是:①减少了水的异味与毒性②用ClO2作消毒剂比用Cl2更安全③等质量的消毒剂,ClO2的消毒能力比Cl2高。ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍。
(1)2NaClO3+Na2SO3+H2SO4==2ClO2↑+2Na2SO4+H2O
(2)2.63
解析:(1)在ClO2中氯元素的化合价为+4,而在NaClO3中氯为+5价,显然,NaClO3作氧化剂,还原剂应当是Na2SO3。
2NaClO3+Na2SO3+H2SO4==2ClO2↑+2Na2SO4+H2O
(2)在消毒时,ClO2和Cl2分别发生如下变化:ClO2![]() Cl-,Cl2
Cl-,Cl2![]() 2Cl-。质量相同的ClO2和Cl2的消毒能力之比就是它们得电子的数目之比。设ClO2和Cl2的质量均为1 g。1 g ClO2得电子
2Cl-。质量相同的ClO2和Cl2的消毒能力之比就是它们得电子的数目之比。设ClO2和Cl2的质量均为1 g。1 g ClO2得电子![]() ×5=2[]27 mol,1 g Cl2得电子
×5=2[]27 mol,1 g Cl2得电子![]() ×2=
×2=![]() mol,则ClO2与Cl2的消毒效率之比为:
mol,则ClO2与Cl2的消毒效率之比为: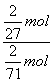 =2.63,即ClO2的消毒效率是Cl2的2.63倍。
=2.63,即ClO2的消毒效率是Cl2的2.63倍。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.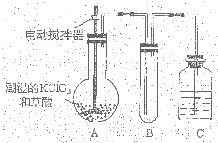 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: