题目内容
【题目】根据能量变化示意图,下列说法正确的是
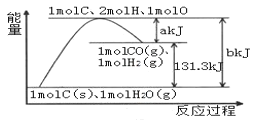
A. 反应物的总能量高于生成物的总能量
B. 2molH和1molO结合生成1molH2O放出热量
C. 1molC和1molH2O反应生成1molCO和1molH2,需要吸收131.3kJ的热量
D. 反应的热化学方程式可表示为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+(a-b)kJ·mol-1
【答案】B
【解析】
由图可知,正反应的活化能为bkJ/mol,逆反应的活化能为akJ/mol,该反应的反应物总能量较低、生成物的总能量较高,所以该反应为吸热反应,反应热为(b-a)kJ/mol=131.3kJ/mol,据此答题。
A.由图中信息可知,该反应是吸热反应,所以反应过程中反应物总能量低于生成物总能量,故A错误;
B.由图中信息可知,1molH2O(g)形成2molH和1molO需要吸收热量,则2molH和1molO结合生成1molH2O放出热量,故B正确;
C.1molC和1molH2O反应生成1molCO和1molH2,反应条件不同、水的状态不同,生成1molCO和1molH2吸收的热量也不同,故C错误;
D.由状态及焓变可知,该反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a)kJ·mol-l,故D错误。
故选B。

练习册系列答案
相关题目