题目内容
【题目】室温时,向20mL 0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气
体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是( )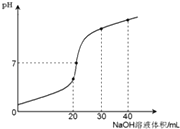
A.PH=7时,溶液中c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C.当V(NaOH)=30mL时,溶液中 c(SO42﹣)+c(H+)=c(NH3H2O)+c(OH﹣)
D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42﹣浓度之和始终为0.1 molL﹣1
【答案】C
【解析】解:A、根据物料守恒可得:c(SO42﹣)=c(NH4+)+c(NH3H2O),则c(SO42﹣)>c(NH4+);由于溶液为中性,则c(H+)=c(OH﹣),根据电荷守恒可得:c(H+)+c(Na+ )+c(NH4+)=c(OH﹣)+2c(SO42﹣),所以c(Na+ )+c(NH4+)=2c(SO42﹣),结合c(SO42﹣)>c(NH4+)可知:c(Na+ )>c(SO42﹣),所以溶液中离子浓度大小为:c(Na+)>c(SO42﹣)>c(NH4+)>c(H+)=c(OH﹣),故A正确;
B、当加入20mL氢氧化钠溶液时,二者反应生成硫酸铵、硫酸钠,由于铵根离子部分水解,促进水的电离,故B正确;
C、根据物料守恒可得:c(SO42﹣)=c(NH4+)+c(NH3H2O),根据电荷守恒可得:c(H+)+c(Na+ )+c(NH4+)=c(OH﹣)+2c(SO42﹣),当V(NaOH)=30mL时,3c(SO42﹣)=2c(Na+ ),化简得c(SO42﹣)+2c(H+)=2c(NH3H2O)+2c(OH﹣),故C错误;
D.设滴入氢氧化钠的体积为xml,30<x<40,c(Na+ )+c(SO42﹣)= ![]() =0.1molL﹣1 , 故D正确;
=0.1molL﹣1 , 故D正确;
故选C.