题目内容
10.下列各组物质混合后,最终有氢氧化钠生成的是②⑤⑧.①Na与足量CuSO4溶液;
②Ca(OH)2溶液与Na2CO3溶液;
③Ca(OH)2溶液与足量NaCl溶液;
④Na2O2与足量FeCl2溶液;
⑤Na与足量Na2SO4溶液;
⑥Na2O2与足量NH4Cl溶液;
⑦Na2O与足量NaHCO3溶液;
⑧Na与足量Na2CO3溶液.
分析 ①Na与足量CuSO4 的溶液反应生成氢氧化铜、硫酸钠和氢气;
②Ca(OH)2 溶液与Na2CO3 溶液反应生成碳酸钙和氢氧化钠;
③Ca(OH)2 溶液和足量的NaCl 溶液不符合离子反应的条件;
④Na2O2与足量FeCl2 的溶液,反应生成氢氧化铁和氯化钠;
⑤Na与足量Na2SO4 的溶液,实质为钠与水反应生成氢氧化钠和氢气;
⑥Na2O2与足量NH4Cl溶液,反应生成氯化钠、氨气和氧气;
⑦Na2O与足量NaHCO3 溶液,氧化钠与水先反应生成氢氧化钠,氢氧化钠与碳酸氢钠反应生成碳酸钠;
⑧Na与足量Na2CO3 溶液,实质钠与水反应生成氢氧化钠和氢气.
解答 解:①Na与足量CuSO4 的溶液反应生成氢氧化铜、硫酸钠和氢气,所以不会产生成氢氧化钠,故①错误;
②Ca(OH)2 溶液与Na2CO3 溶液反应生成碳酸钙和氢氧化钠,能够得到氢氧化钠,故②正确;
③Ca(OH)2 溶液和足量的NaCl 溶液不符合离子反应的条件,不反应,不会产生氢氧化钠,故③错误;
④Na2O2与足量FeCl2 的溶液,反应生成氢氧化铁和氯化钠,得不到氢氧化钠,故④错误;
⑤Na与足量Na2SO4 的溶液,实质为钠与水反应生成氢氧化钠和氢气,能够得到氢氧化钠,故⑤正确;
⑥Na2O2与足量NH4Cl溶液混合,过氧化钠先与水反应生成氢氧化钠和氧气,氢氧化钠再与氯化铵反应生成氨气和氯化钠,反应得不到氢氧化钠,故⑥错误;
⑦Na2O与足量NaHCO3 溶液,氧化钠与水先反应生成氢氧化钠,氢氧化钠与碳酸氢钠反应生成碳酸钠,得不到氢氧化钠,故⑦错误;
⑧Na与足量Na2CO3 溶液,实质钠与水反应生成氢氧化钠和氢气,能够得到氢氧化钠,故⑧正确;
故答案为:②⑤⑧.
点评 本题考查了元素化合物知识明确物质的性质和离子反应的条件是解题的关键,题目难度不大,注意Na与溶液的是先与水反应,再考虑生成的NaOH是否与溶液中溶质反应.

| A. | 高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降 | |
| B. | 工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子 | |
| C. | 高铁酸钾中Fe为+6价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钾能除去水中溶解的H2S等 |
| A. | 汽油和水,四氯化碳和水 | B. | 汽油和水,苯和水 | ||
| C. | 食用油和水,醋酸和水 | D. | 葡萄糖和水,酒精和水 |
 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,它极易与水反应.为在实验室合成S2Cl2,某化学研究性学习小组查阅有关资料,有如下两种反应原理:
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,它极易与水反应.为在实验室合成S2Cl2,某化学研究性学习小组查阅有关资料,有如下两种反应原理:①CS2+3Cl2$\stackrel{95-100℃}{→}$CCl4+S2Cl2;②2S+Cl2$\stackrel{50-60℃}{→}$S2Cl2.
几种物质的熔、沸点数据如下表所示:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
(2)B中盛放饱和氯化钠溶液,其作用是除去氯化氢;C中盛放试剂的名称是浓硫酸.
(3)D装置中水从冷凝管下端通入(选填“上”或“下”).反应结束后,从D装置锥形瓶内的混合物中分离出产品的操作为蒸馏(填名称).
(4)S2Cl2与水反应产生无色、有刺激性气味的气体,并有黄色沉淀生成,该反应的化学万程式为2S2Cl2+2H2O=S↓+SO2↑+4HCl.

 现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.
现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.
 Ⅱ
Ⅱ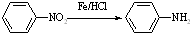 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; +2NaOH→
+2NaOH→ +HCOONa+H2O.
+HCOONa+H2O.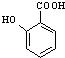 有多种同分异构体,其中含符合下列条件的共有2种.
有多种同分异构体,其中含符合下列条件的共有2种. 的过程.
的过程. .B与乙醇发生酯化反应生成X的化学方程式为
.B与乙醇发生酯化反应生成X的化学方程式为 +H2O.
+H2O.
 经过几步有机反应制得,其中最佳的次序是:a.
经过几步有机反应制得,其中最佳的次序是:a.
 .
.