题目内容
【题目】某天然碱样品的组成可能为aNa2CO3bNaHCO3cH2O(a、b、c为正整数)。为确定其组成,某小组进行如下实验:
(1)定性实验
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。___________(填“能”或“不能”)说明样品中含结晶水,试简述理由 ;
②请设计一个简单方案,确认样品中含有CO32- 。
(2)定量分析
该同学设计了如下图所示装置,测定天然碱的化学组成。
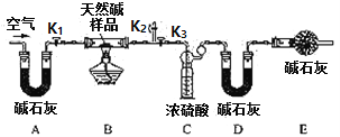
实验步骤:
①组装好实验装置后,首先进行的操作是 ;A处碱石灰的作用是;E处碱石灰的作用是 。
②称7.3g样品,放入硬质玻璃管中;称量C装置质量为87.6g,D装置为74.7g。
③打开活塞K1、K2,关闭K3,通入空气数分钟。
④关闭活塞Kl、K2,打开K3,点燃酒精灯至不再产生气体为止。
⑤打开活塞Kl,鼓入空气数分钟,然后称得C装置质量为88.5g;D装置质量为75.8g,通入空气的目的是 。
⑥如果a=1,则该天然碱的化学式为 。
【答案】(1)①不能 因为NaHCO3受热分解也能产生水蒸气
②取少量天然碱样品溶于水,加入足量的氯化钙溶液或氯化钡溶液,过滤并洗涤沉淀,向沉淀中加入稀盐酸,将产生的气体通入澄清石灰水,若出现浑浊现象说明样品中含CO32-
(2)①检查装置的气密性 除去空气中的CO2和H2O(g)
防止空气中CO2和H2O(g)进入D装置,导致测量不准确
⑤将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收 ⑥Na2CO32NaHCO3H2O
【解析】
试题分析:(1)①由于反应2NaHCO3![]() Na2CO3+CO2↑+H2O中有水生成,所以不能说明样品中含结晶水;
Na2CO3+CO2↑+H2O中有水生成,所以不能说明样品中含结晶水;
②确认样品中含有CO32,可以取少量天然碱样品溶于水,加入足量的氯化钙溶液或氯化钡溶液,过滤并洗涤沉淀,向沉淀中加入稀盐酸,将产生的气体通入澄清石灰水,若出现浑浊现象说明样品中含CO32-;
(2)①该实验中使用了多个实验装置,在实验前必须检查装置的气密性,避免影响测定结果;装置A中的碱石灰作用是除去空气中的CO2和H2O(g),E处碱石灰的作用是防止空气中的CO2和H2O进入,造成测量误差;
⑤该步骤中缓缓鼓入空气的目的是将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收,减小测定误差;
⑥由题意可知:装碱石灰的U形管D的增重的物质是CO2,二氧化碳的质量为:75.8 g-74.7g=1.1 g,n(CO2)=![]() =0.025 mol,则
=0.025 mol,则
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2 1 1 1
0.05mol 0.025mo 0.025mol 0.025mol
m(NaHCO3)=0.05 mol×84 gmol-1=4.2 g,浓硫酸吸收的水为碳酸氢钠分解生成的和样品中的结晶水,水的质量之和为:88.5g-87.6g=0.9g,所以晶体中含有的结晶水的物质的量为:n(H2O)=![]() -0.025mol=0.025mol,样品中含有的结晶水的质量为:m(H2O)=0.025 mol×18 gmol-1=0.45g,样品中含有的水的质量为:m(Na2CO3)=7.3g-4.2g-0.45g=2.65g,n(Na2CO3)=
-0.025mol=0.025mol,样品中含有的结晶水的质量为:m(H2O)=0.025 mol×18 gmol-1=0.45g,样品中含有的水的质量为:m(Na2CO3)=7.3g-4.2g-0.45g=2.65g,n(Na2CO3)=![]() =0.025mol,故晶体中n(Na2CO3):n(NaHCO3):n(H2O)=0.025 mol:0.05 mol:0.025 mol=1:2:1,所以晶体化学式为:Na2CO32NaHCO3H2O,故答案为:Na2CO32NaHCO3H2O。
=0.025mol,故晶体中n(Na2CO3):n(NaHCO3):n(H2O)=0.025 mol:0.05 mol:0.025 mol=1:2:1,所以晶体化学式为:Na2CO32NaHCO3H2O,故答案为:Na2CO32NaHCO3H2O。