题目内容
下列对实验现象的描述中错误的是
| A.向FeCl3和KSCN混合溶液中加入少量KCl固体,溶液血红色变浅 |
| B.向5mL 0.1mol/L K2Cr2O7溶液中加入少量NaOH固体,溶液由橙色变为黄色 |
| C.等体积等浓度Na2S2O3和H2SO4混合,温度升高出现浑浊和生成气体速度加快 |
| D.酸性KMnO4溶液中滴加H2C2O4,H2C2O4浓度越大褪色和生成气体速度越快 |
A
试题分析:A、加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动,溶液颜色无明显变化,故A错误;B、Cr2O72-+H2O
 2CrO42-+2H+加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液由橙色变为黄色,故B正确;C、温度越高、浓度越大,则反应速率就越快,Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,故C正确;D、该反应是一条自催化反应,即反应生成的锰离子可以作为催化剂。所以开始加入草酸溶液时,随着草酸的不断滴入,锰离子浓度增大,反应速率增大,即褪色和生成气体速度越快,故D正确。
2CrO42-+2H+加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液由橙色变为黄色,故B正确;C、温度越高、浓度越大,则反应速率就越快,Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,故C正确;D、该反应是一条自催化反应,即反应生成的锰离子可以作为催化剂。所以开始加入草酸溶液时,随着草酸的不断滴入,锰离子浓度增大,反应速率增大,即褪色和生成气体速度越快,故D正确。
练习册系列答案
相关题目

 N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
 MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
 Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
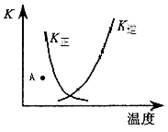
 Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是  xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)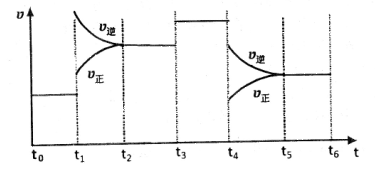
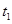 、
、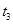 、
、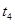 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化?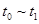 B.
B.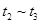 C.
C.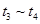 D.
D.