题目内容
【题目】如图为相互串联的甲乙两电解池. 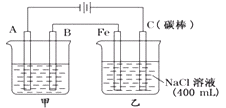
(1)甲池若为用电解原理精炼铜的装置,①A是极,材料是 , 电极反应为 , ②B是极,材料是 , 主要电极反应为 , 电解质溶液为 .
(2)写出乙池中发生的总反应的离子方程式 .
(3)若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为L.
(4)若此时乙池剩余液体为400mL,则电解后得到碱液的物质的量浓度为mol/L.
【答案】
(1)阴;精铜(或纯铜);Cu2++2e﹣=Cu;阳;粗铜;Cu﹣2e﹣=Cu2+;硫酸铜溶液;
(2)2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑
2OH﹣+H2↑+Cl2↑
(3)44.8
(4)1
【解析】解:(1)①A与电源的负极相连,是电解池的阴极,所以是纯铜,发生还原反应,电极反应为:Cu2++2e﹣=Cu,所以答案是:阴,精铜(或纯铜),Cu2++2e﹣=Cu;②B是电解池的阳极铜发生氧化反应,电极反应式为Cu﹣2e﹣=Cu2+ , 电解液是含可溶性铜离子的电解质溶液,可以是硫酸铜溶液,所以答案是:阳,粗铜,Cu﹣2e﹣=Cu2+ , 硫酸铜溶液;
(2.)乙池是电解氯化钠溶液,发生的总反应的离子方程式2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑,所以答案是:2Cl﹣+2H2O
2OH﹣+H2↑+Cl2↑,所以答案是:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;
2OH﹣+H2↑+Cl2↑;
(3.)由
2Cu | ~ | Cl2↑ |
64g | 22.4L | |
12.8g | 44.8L |
所以答案是:44.8L;
(4.)由2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑可知,生成氢氧化钠的物质的量为0.4mol,所以c=
2OH﹣+H2↑+Cl2↑可知,生成氢氧化钠的物质的量为0.4mol,所以c= ![]() =
= ![]() =1mol/L,所以答案是:1.
=1mol/L,所以答案是:1.

【题目】如表是甲同学研究氯水性质实验片段的活动记录.
实验内容 | 实验现象 | 解释及结论 |
观察氯水的颜色、状态 | 呈黄绿色 | ① |
向氯水中滴入几滴硝酸银溶液 | 有白色沉淀 | ② |
用玻璃棒蘸取氯水,点在蓝色石蕊试纸上 | 滴有氯水的试纸中间变白,外圈变红 | ③ |
(1)根据上述实验内容和现象,选择合理解释填到表中(填序号)A.氯化中存在Cl﹣
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了进行探究(填序号)
A.观察法
B.比较法
C.分类法
D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.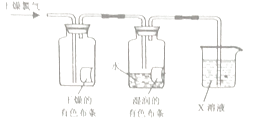
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是 .
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式 .




