题目内容
(12分,除注明外,每空2分)
(1)3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,故而水倒吸一定高度。O2耗完后,生成的NO开始排出导管口,故有此现象。
(3)①U形管短管中充满液体(1分) ②U形管底部(1分)
③当硝酸与铜丝脱离接触时反应自动停止,在U形管短管上部可以观察到无色NO
④U形管长管内液面下降,短管内液面上升,在分液漏斗中可观察到红棕色气体
⑤关闭分液漏斗活塞
解析试题分析:(1)铜与稀硝酸反应的化学方程式3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)如果采用(a)装置,若加入20mL,6mol/LHNO3和2g薄铜片,在反应开始时,可观察到水槽内的导管中水面先慢慢上升到一定高度,此后又回落,然后有气泡从导管口冒出。反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,故而水倒吸一定高度。O2耗完后,生成的NO开始排出导管口,故有此现象。
(3)如果采用(b)装置,①将活塞打开,从U形管的长管口注入稀硝酸,一直注到U形管短管中充满液体为止。②关闭活塞,用酒精灯在U形管底部微热,当反应发生时,立即撤去酒精灯。
③当硝酸与铜丝脱离接触时反应自动停止,在U形管短管上部可以观察到无色NO。
④U形管长管内液面下降,短管内液面上升,在分液漏斗中可观察到红棕色气体。
⑤如果需再获得N0与已生成NO2的形成鲜明对照的实验效果,应关闭分液漏斗活塞。
考点:用稀HNO3与Cu反应来制备NO气体的实验即评价。

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作 极。
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作 极,反应的离子方程式 。
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
 CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
通过计算,该反应的平衡常数为: 。
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)一定条件下2NH3(g) △H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图:

①与实验I比较,实验II改变的条件为: 。
②实验III比实验I的温度要高,其它条件相同,请在下图画出实验I和实验III中NH3浓度随时间变化的示意图。

(18分) (1)某实验小组的甲同学用图l所示装置制取少量乙酸乙酯(加热设备及夹持固定装置均略去)。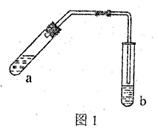
①试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
②试管a中加入碎瓷片的作用是 ,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填序号)。
| A.立即补加 | B.不需补加 | C.冷却后补加 | D.重新配料 |
④试管b中盛有饱和Na2CO3溶液,其作用是 。
⑤反应结束后,振荡试管b,静置。观察到的现象是 。
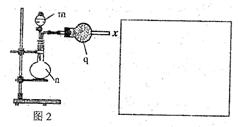
(2)该小组的乙同学利用图2所示装置制备并收集干燥的NO2气体。
①图2中仪器n的名称是 。
②请在方框内画出用集气瓶收集NO2的装置图。
③写出仪器n中发生反应的离子方程式: 。
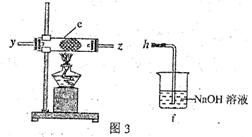
(3)该小组的丙同学利用图2所示装置制取NH3和O2的混合气体,并且利用图3所示装置验证NH3的某些性质。m中加入浓氨水,q中加入碱石灰,e内放置催化剂(铂石棉),按气流方向连接各仪器x→y→z→h。
①图2仪器n内需加入固体试剂的名称为 。
②实验中观察到e内有红棕色气体出现,证明氨气具有 性,e中发生反应的化学方程式为 。
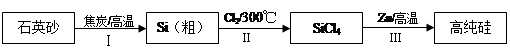
 Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0 


 MnCl2 + C12↑+ 2 H2O):
MnCl2 + C12↑+ 2 H2O):