题目内容
含有1mol HNO3的稀硝酸分别与不同物质的量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
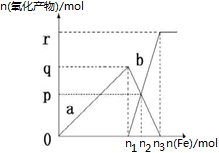

| A.a是Fe(NO3)2 | B.n1=0.375 | C.p=0.20 | D.n2=0.30 |
D
试题分析:向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为1mol利用方程式可计算出生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,a为 Fe(NO3)3,故AB错误;C选项,Fe(NO3)3与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe="3" Fe(NO3)2,P点为 Fe(NO3)3与 Fe(NO3)2物质的量相等的点,设生成的 Fe(NO3)2物质的量xmol,则利用方程式可求得x=0.15,即P=0.15,故C错误;D选项,再根据铁原子守恒,n(Fe)=n(Fe((NO3)2)+n (Fe(NO3)3),所以 n(Fe)=0.3mol即n2=0.3mol,故D正确。

练习册系列答案
相关题目

 2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA
2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA