题目内容
 实验是科学探究的重要途径,请将下列有关实验的问题填写完整.
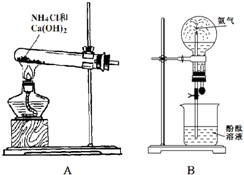
实验是科学探究的重要途径,请将下列有关实验的问题填写完整.I.化学兴趣小组的同学用图装置A制备氨气.并用装置B探究氨气的部分性质:
(1)装置A中发生反应的化学方程式为
(2)打开装置B中橡皮管上的止水夹.将胶头滴管中的水挤入盛满干燥氨气的烧瓶中,可观察到烧杯中的水迅速进入烧瓶,形成喷泉,由此说明氨气的溶解性是
II.海洋植物如海带、海藻中含有丰富的碘元素.碘元素以碘离子的形式存在.实验室里从海洋中提取碘的流程如下:

化学兴趣小组将上述流程②,③设计如图:
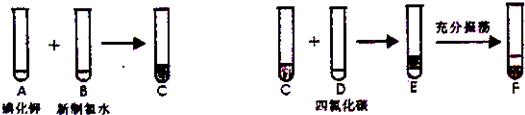
(1)写出提取过程①、③中实验操作名称:①
(2)写出过程②中有关反应的化学方程式
(3)F中下层液体的颜色为
分析:Ⅰ、(1)装置图分析信息可知A中发生反应是实验室制备氨气的反应,是氯化铵和氢氧化钙固体加热反应生成氨气;检验氨气可以利用湿润的石蕊试纸变蓝验证;
(2)装置图是氨气的喷泉实验,易形成喷泉说明氨气极易溶于水,氨气和水反应生成的一水合氨电离处氢氧根离子使溶液呈碱性,酚酞变红色;
Ⅱ、(1)分离固体和溶液通常采用过滤操作,分离互溶液体通常采用蒸馏的方法;
(2)氯气可将碘离子氧化为碘单质;
(3)F中利用碘单质在四氯化碳中溶解度大,四氯化碳比水重,上层为氯化钾;
(2)装置图是氨气的喷泉实验,易形成喷泉说明氨气极易溶于水,氨气和水反应生成的一水合氨电离处氢氧根离子使溶液呈碱性,酚酞变红色;
Ⅱ、(1)分离固体和溶液通常采用过滤操作,分离互溶液体通常采用蒸馏的方法;
(2)氯气可将碘离子氧化为碘单质;
(3)F中利用碘单质在四氯化碳中溶解度大,四氯化碳比水重,上层为氯化钾;
解答:解:Ⅰ、(1)装置图分析信息可知A中发生反应是实验室制备氨气的反应,是氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;检验氨气可以利用湿润的石蕊试纸变蓝验证,实验步骤是;用湿润的红色石蕊试纸靠近试管口处变蓝色证明集满;
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;用湿润的红色石蕊试纸靠近试管口处变蓝色证明集满;
(2)将胶头滴管中的水挤入盛满干燥氨气的烧瓶中,可观察到烧杯中的水迅速进入烧瓶,形成喷泉,装置图是氨气的喷泉实验,易形成喷泉说明氨气极易溶于水,氨气和水反应生成的一水合氨电离处氢氧根离子使溶液呈碱性,酚酞变红色;
故答案为:极易溶于水,红色,碱性;
Ⅱ、(1)根据流程可知,分离不溶物与溶液的方法为过滤,因为碘在有机溶剂中的溶解度比水大,且碘和有机溶剂易于分离,所以用萃取;
故答案为:过滤;萃取;
(2)提取碘元素,是利用含碘离子的溶液中通入氯气氧化碘离子为碘单质,用四氯化碳萃取分离,步骤②发生的反应离子方程式为:2KI+Cl2=2KCl+I2;
故答案为:2KI+Cl2=2KCl+I2;
(3)四氯化碳不溶于水,比水重,碘单质在四氯化碳中溶解度大于水中,四氯化碳层为紫红色,上层为主要溶质是氯化钾;
故答案为:紫红,KCl.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)将胶头滴管中的水挤入盛满干燥氨气的烧瓶中,可观察到烧杯中的水迅速进入烧瓶,形成喷泉,装置图是氨气的喷泉实验,易形成喷泉说明氨气极易溶于水,氨气和水反应生成的一水合氨电离处氢氧根离子使溶液呈碱性,酚酞变红色;
故答案为:极易溶于水,红色,碱性;
Ⅱ、(1)根据流程可知,分离不溶物与溶液的方法为过滤,因为碘在有机溶剂中的溶解度比水大,且碘和有机溶剂易于分离,所以用萃取;
故答案为:过滤;萃取;
(2)提取碘元素,是利用含碘离子的溶液中通入氯气氧化碘离子为碘单质,用四氯化碳萃取分离,步骤②发生的反应离子方程式为:2KI+Cl2=2KCl+I2;
故答案为:2KI+Cl2=2KCl+I2;
(3)四氯化碳不溶于水,比水重,碘单质在四氯化碳中溶解度大于水中,四氯化碳层为紫红色,上层为主要溶质是氯化钾;
故答案为:紫红,KCl.
点评:本题考查了氨气的实验制备和氨气性质分析应用,物质的分离和提纯,题目浓难度不大,掌握过滤、萃取、蒸馏等操作方法是解答本题的关键,注意明确采用萃取操作时,萃取剂的选择原则.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目