题目内容
【题目】下列关于氯气、氯水的叙述中正确的是( )
A. 氯气、液氯、氯水是同一种物质
B. 新制氯水可以使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡逸出,逸出的气体是氯气
D. 新制氯水放置数天后pH变大
【答案】B
【解析】
A、氯气溶于水即得到氯水,即氯水是混合物,氯气、液氯是纯净物,A错误;
B、次氯酸具有强氧化性,氯水中的盐酸具有酸性,所以新制氯水可以使蓝色石蕊试纸先变红后褪色,B正确;
C、次氯酸不稳定,见光分解生成氯化氢和氧气,则溢出的气体是氧气,C错误;
D、随着次氯酸的分解,氯水逐渐变为稀盐酸,所以酸性增强,pH变小,漂白性逐渐减弱,直至消失,D错误;
答案选B。

【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是:CuFeS2+4Fe3+=Cu2++5Fe2++2S
(1)上述总反应的原理如图1所示。正极的电极反应式是_______________________________。
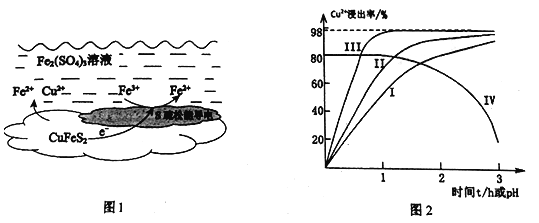
(2)一定温度下,控制浸取剂pH=1,总体积为1L,取三份相同质量黄铜矿粉末分别进行实验,结果如图2:
实验 | 操作 |
I | 加入足量0.100 molL-1Fe2(SO4)3溶液 |
II | 加入足量0.100 molL-1Fe2(SO4)3溶液,通入空气 |
Ⅲ | 加入足量0.100 molL-1Fe2(SO4)3溶液,再加入少量 0.000500 molL-1Ag2SO4溶液 |
①曲线IV是在实验I的基础上改变溶液的pH所得实验结果,请分析pH从2到3,Cu2+浸出率明显下降的原因____________________________(用离子方程式描述)。
②对比实验I、Ⅱ,通入空气,Cu2+浸出率提髙的原因是_________________________。
③由实验Ⅲ推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
i . CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ii.……
写出上述ii的离子方程式_____________________________________________。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-lAg2SO4溶液,充分混合后静置。取上层淸液,加入稀盐酸,观察到溶液中_______________________,证明发生反应i
b.取少量Ag2S粉末,加入________________溶液,充分混合后静置。取上层淸液,加入稀盐酸,有白色沉淀,证明发生反应ii
④若实验中样品含铜a mol,则实验I的平衡常数K=_____________(杂质不参与反应,只要求列出计算式,不必算出结果)。
(3)为了进一步研究上述实验Ⅲ结论的可靠性,査得资料Ksp(Ag2S)=6.4×10-50,Ksp(AgCl)=1.8×10-10,试计算,使饱和Ag2S溶液中的Ag+开始转化为AgCl沉淀所需盐酸的最低浓度为____________ mol/L (己知![]() ≈2.5)。
≈2.5)。