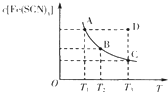
题目内容
【题目】已知葡萄糖(C6H12O6)的燃烧热是2804kJ·mol-1,当它在人体内氧化生成1g水时放出的热量约为( )
A.26.0kJB.51.9kJC.155.8kJD.467.3kJ
【答案】A
【解析】
根据燃烧热的概念可知,1mol葡萄糖燃烧放出2804 kJ热量时生成6mol液态水,即108g水,通过假设生成1g液态水时放出的热量是x kJ,列式计算即可。
葡萄糖的燃烧热是2804kJ/mol,可知葡萄糖的燃烧热的热化学方程式为C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l) △H=-2804kJ/mol,即生成108gH2O放出2804kJ的热量,设生成1g液态水时放出的热量是x kJ,可得:
6CO2(g)+6H2O(l) △H=-2804kJ/mol,即生成108gH2O放出2804kJ的热量,设生成1g液态水时放出的热量是x kJ,可得:![]() =
=![]() 解得:x=26.0kJ,答案选A。
解得:x=26.0kJ,答案选A。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
【题目】比较纯碱的两种工业制法,正确的是
选项 | 项目 | 氨碱法 | 联合制碱法 |
A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
B. | 可能的副产物 | 氯化钙 | 氯化铵 |
C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
A.AB.BC.CD.D
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)在周期表中,与元素b的化学性质最相似的邻族元素是________(填写以上表中字母对应的元素符号),该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
(2)元素As与________同族(填写以上表中字母对应的元素符号),其简单气态氢化物的稳定性由大到小的顺序是________。
(3)基态ρ原子成为阳离子时首先失去________轨道电子,基态![]() 的最外层电子排布式________。
的最外层电子排布式________。
(4)i的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式为________________。
(5)下列关于上图表中元素说法正确的是________(填序号)。
①未成对电子数最多的元素是O
②元素的电负性强弱;![]()
③元素的第一电离能:![]()
④简单离子半径:![]()