��Ŀ����
����Ŀ��ij��ѧ��ȤС���ͬѧ���в�����������(FeC2O4��nH2O)�ֽ��ʵ��̽������С�����ۣ��������������װ�ý���ʵ�顣 ��ƿB��ʢ�б���NH4Cl�ͱ���NaNO2���Һ(������ʵ������N2)�������C1��C4��װ�м�ʯ�ң��Թ�E1��E3��E4��װ�г���ʯ��ˮ��
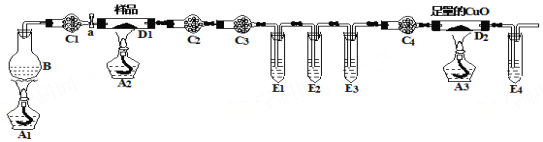
��1����ַ�Ӧ��D1�еĹ��������Ͷ����������е�ϡ�����У�������ȫ�ܽ���������ų���ȡ��ӦҺ����KSCN��Һ��Ѫ��ɫ��֤���������Ϊ ��д��ѧʽ����
��2����װ������3���ƾ��ƣ�����ʵ���������Ӧ�õ� �ξƾ��ƣ����һ�ε�ȼ���� ������ƾ����µ���ĸ��
��3����ʵ��װ������4��ֱ�����Թܣ�������ʢ���Լ����ֲ�ͬ�����ã�����E3�������ǣ� ��
��4����ʵ��װ������4������ܣ�C3��ʢװ���Լ��� ��
��5��ȡ7.2 g��Ʒ��ַ�Ӧ���D1�еĹ��������Ϊ2.88 g��D2�й�����������0.64 g���������������(FeC2O4��nH2O)�ֽ�ķ���ʽΪ ��
���𰸡���1��FeO����2��4��A1����3����֤�����е�CO2�Ƿ�������
��4��P2O5��CaCl2����5��FeC2O42H2O![]() FeO+CO��+CO2��+2H2O��
FeO+CO��+CO2��+2H2O��
��������
�����������1��������������е�ϡ���ᣬ��ֹ������Ӱ��ʵ�飨Fe2��������Fe3�����������������˵����CO32��������KSCN��Һ��Ѫ��ɫ��˵����Ԫ���ԣ�2�۴��ڣ���˹��������FeO��(2)A3�Ǽ��黹ԭ������ڣ���������CO��CO�ǿ�ȼ�����壬��Ҫ���鴿�ȣ���ֹ����Σ�գ������Ҫ4�ε�ȼ�ƾ��ƣ����һ�ε�ȼ�ƾ�����A1��Ŀ���Dz���N2����FeC2O4�ֽ���������壬ȫ�������գ���3��E1�Ǽ���FeC2O4�ֽ���������Ƿ���CO2��E3����֤�����е�CO2�Ƿ���������4��C2�������Ǽ���ˮ������ʢ����ˮ����ͭ��C3�����ÿ����Ƿ�ֹE1��ˮ��������C2���������ţ�C3ʢ�Ÿ������������ʢ�ż�ʯ�һ���ʯ�ң����Ӧ��P2O5��CaCl2��(5)����(1) ��������FeO�������ʵ���Ϊ2.88/72mol=0.04mol��������Ԫ���غ㣬FeC2O4��nH2O�����ʵ���Ϊ0.04mol��D2������������0.64g�����ٵ���ԭ�ӵ�����Ϊ0.64g����CO�����ʵ���Ϊ0.64/16mol=0.04mol������̼Ԫ���غ㣬CO2�����ʵ���Ϊ0.04mol����������Ϊ7.2g�������7.2/(144��18n)=0.04�����n=2����˲�����������Ļ�ѧʽΪFeC2O4��2H2O��������ȷֽ�ķ�Ӧ����ʽΪ��FeC2O42H2O![]() FeO+CO��+CO2��+2H2O��
FeO+CO��+CO2��+2H2O��


