题目内容
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.(1)铁元素在元素周期表中的位置是______.
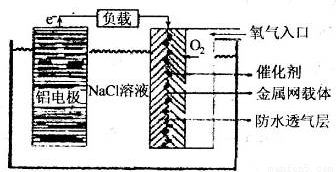
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.
①该电池的总反应化学方程式为______;
②电池中NaCl的作用是______.
(3)用铝电池电解CuSO4溶液(电极均为铂电极),通电一段时间后,一极上析出红色固体,另一极的电极反应式为______,此时向溶液中加入8g CuO固体后可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为______L.
(4)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式______ 2AlCl3+3CO.
【答案】分析:(1)铁元素位于第四周期第VIII族;
(2)①铝和氧气、水能反应生成氢氧化铝;
②溶液中自由移动的离子浓度越大,溶液的导电性越强;
(3)用铝电池电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;根据原子守恒计算氧气的体积;
(4)根据反应物、生成物和反应条件写出反应方程式;
(5)①将Fe2O3和Cu2O组成的混合物放入足量稀硫酸中,氧化铁与硫酸反应生成硫酸铁与水,氧化亚铜与硫酸反应生成铜、硫酸铜与水,铜与硫酸铁反应生成硫酸亚铁、硫酸铜;
②铁离子能和硫氰化钾溶液反应生成络合物,溶液由黄色变为血红色;亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
③若实验中观察到溶液变为蓝色且有固体剩余,说明铜有剩余,溶液中硫酸铁完全转化为硫酸亚铁,根据①中的方程式计算判断.
解答:解:(1)铁是26号元素,位于第四周期第VIII族,故答案为:第四周期第VIII族;
(2)①铝和氧气、水能反应生成氢氧化铝,反应方程式为:4Al+3O2+6H2O=4Al(OH)3,故答案为:4Al+3O2+6H2O=4Al(OH)3;
②溶液中自由移动的离子浓度越大,溶液的导电性越强,水是弱电解质导电能力较小,为增大水的导电性,所以加入氯化钠,
故答案为:增强溶液的导电能力;
(3)用铝电池电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电而析出铜,阳极上电极反应式为:4OH--4e-=O2↑+2H2O,向溶液中加入8gCuO固体后可使溶液恢复到电解前的浓度,则阳极上析出氧气的质量等于氧化铜中氧原子的质量,根据原子守恒知,氧气的体积=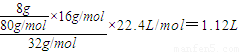 ,故答案为:4OH--4e-=O2↑+2H2O,1.12L;
,故答案为:4OH--4e-=O2↑+2H2O,1.12L;
(4)加热条件下,氯气、氧化铝和碳反应生成氯化铝和一氧化碳,反应方程式为:Al2O3+3C+3Cl2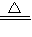 2AlCl3+3CO,
2AlCl3+3CO,
故答案为:Al2O3+3C+3Cl2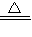 2AlCl3+3CO;
2AlCl3+3CO;
(5)①将Fe2O3和Cu2O组成的混合物放入足量稀硫酸中废水反应,氧化铁与硫酸反应生成硫酸铜与水,氧化亚铜与硫酸反应生成铜、硫酸铜与水,生成的铜与硫酸铁反应生成硫酸亚铁、硫酸铜,反应离子方程式依次为Fe2O3+6H+=2Fe3++3H2O,Cu2O+2H+=Cu+Cu2++H2O,Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;Cu+2Fe3+=2Fe2++Cu2+;
②铁离子能和硫氰化钾溶液反应生成络合物,溶液由黄色变为血红色;亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以检验方法为:取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子,
故答案为:取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子;
③若实验中观察到溶液变为蓝色且有固体剩余,说明铜有剩余,溶液中硫酸铁完全转化为硫酸亚铁,由Cu+2Fe3+=2Fe2++Cu2+可知n(Cu)>2n(Fe3+),由Fe2O3+6H+=2Fe3++3H2O可知n(Fe3+)=2n(Fe2O3),由Cu2O+2H+=Cu+Cu2++H2O可知n(Cu)=n(Cu2O),则n(Cu2O)>2n(Fe2O3),.
故答案为:>.
点评:本题考查电解原理、离子方程式的书写、离子检验等知识点,这些都是考试热点,铁离子和亚铁离子的检验中要会运用化学语言描述实验现象,为易错点.
(2)①铝和氧气、水能反应生成氢氧化铝;
②溶液中自由移动的离子浓度越大,溶液的导电性越强;
(3)用铝电池电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;根据原子守恒计算氧气的体积;
(4)根据反应物、生成物和反应条件写出反应方程式;
(5)①将Fe2O3和Cu2O组成的混合物放入足量稀硫酸中,氧化铁与硫酸反应生成硫酸铁与水,氧化亚铜与硫酸反应生成铜、硫酸铜与水,铜与硫酸铁反应生成硫酸亚铁、硫酸铜;
②铁离子能和硫氰化钾溶液反应生成络合物,溶液由黄色变为血红色;亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
③若实验中观察到溶液变为蓝色且有固体剩余,说明铜有剩余,溶液中硫酸铁完全转化为硫酸亚铁,根据①中的方程式计算判断.
解答:解:(1)铁是26号元素,位于第四周期第VIII族,故答案为:第四周期第VIII族;
(2)①铝和氧气、水能反应生成氢氧化铝,反应方程式为:4Al+3O2+6H2O=4Al(OH)3,故答案为:4Al+3O2+6H2O=4Al(OH)3;
②溶液中自由移动的离子浓度越大,溶液的导电性越强,水是弱电解质导电能力较小,为增大水的导电性,所以加入氯化钠,
故答案为:增强溶液的导电能力;
(3)用铝电池电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电而析出铜,阳极上电极反应式为:4OH--4e-=O2↑+2H2O,向溶液中加入8gCuO固体后可使溶液恢复到电解前的浓度,则阳极上析出氧气的质量等于氧化铜中氧原子的质量,根据原子守恒知,氧气的体积=
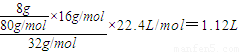 ,故答案为:4OH--4e-=O2↑+2H2O,1.12L;
,故答案为:4OH--4e-=O2↑+2H2O,1.12L;(4)加热条件下,氯气、氧化铝和碳反应生成氯化铝和一氧化碳,反应方程式为:Al2O3+3C+3Cl2
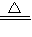 2AlCl3+3CO,
2AlCl3+3CO,故答案为:Al2O3+3C+3Cl2
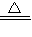 2AlCl3+3CO;
2AlCl3+3CO;(5)①将Fe2O3和Cu2O组成的混合物放入足量稀硫酸中废水反应,氧化铁与硫酸反应生成硫酸铜与水,氧化亚铜与硫酸反应生成铜、硫酸铜与水,生成的铜与硫酸铁反应生成硫酸亚铁、硫酸铜,反应离子方程式依次为Fe2O3+6H+=2Fe3++3H2O,Cu2O+2H+=Cu+Cu2++H2O,Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;Cu+2Fe3+=2Fe2++Cu2+;
②铁离子能和硫氰化钾溶液反应生成络合物,溶液由黄色变为血红色;亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以检验方法为:取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子,
故答案为:取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子;
③若实验中观察到溶液变为蓝色且有固体剩余,说明铜有剩余,溶液中硫酸铁完全转化为硫酸亚铁,由Cu+2Fe3+=2Fe2++Cu2+可知n(Cu)>2n(Fe3+),由Fe2O3+6H+=2Fe3++3H2O可知n(Fe3+)=2n(Fe2O3),由Cu2O+2H+=Cu+Cu2++H2O可知n(Cu)=n(Cu2O),则n(Cu2O)>2n(Fe2O3),.
故答案为:>.
点评:本题考查电解原理、离子方程式的书写、离子检验等知识点,这些都是考试热点,铁离子和亚铁离子的检验中要会运用化学语言描述实验现象,为易错点.

练习册系列答案
相关题目


 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.