题目内容
对于0.1mol·L-1的Na2S溶液,下列判断正确的是
- A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
- B.c(Na+)=2c(S2-)+c(OH-)+c(HS-)
- C.向Na2S溶液中加水稀释,其所有离子的浓度都减小
- D.向溶液中加入少量NaOH固体,能促进水的电离
A
正确答案:A
A、S2―分步水解,以第一步为主,但水解的量仍很少:S2―+H2O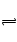 HS―+OH―; HS―+H2O
HS―+OH―; HS―+H2O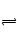 H2S+OH―
H2S+OH―
阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
B、电荷守恒,应为c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-)
C.向Na2S溶液中加水稀释,溶液的酸性增强,c(H+)变大
D.向溶液中加入少量NaOH固体,碱性增强,抑制水电离
正确答案:A
A、S2―分步水解,以第一步为主,但水解的量仍很少:S2―+H2O
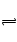 HS―+OH―; HS―+H2O
HS―+OH―; HS―+H2O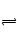 H2S+OH―
H2S+OH―阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
B、电荷守恒,应为c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-)
C.向Na2S溶液中加水稀释,溶液的酸性增强,c(H+)变大
D.向溶液中加入少量NaOH固体,碱性增强,抑制水电离

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目