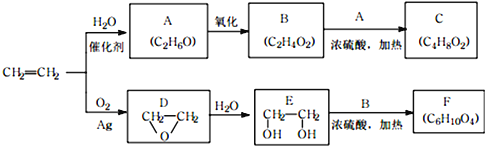
题目内容
【题目】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如下图所示(有些夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。
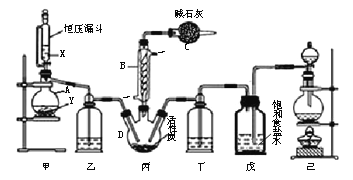
(1)单独检验己装置气密性的方法是:_______。
(2)由仪器B的使用可知SO2与Cl2反应的ΔH_______0(填“>”或“<”),仪器C的作用是_______。
(3)试剂X、Y的组合最好是________。
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3+Na2SO3 c.60% H2SO4+K2SO3
(4)反应结束后,将丙中产物分离的实验操作是_______。
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液w。
①写出该反应的离子方程式:________;
②检验溶液w中存在Cl-的方法是________。
(6)SO2Cl2可以作为锂离子电池的正极活性材质,已知电池反应为:2Li+SO2Cl2=2LiCl +SO2↑。则电池工作时,正极的电极反应式为_________。
【答案】 关闭分液漏斗活塞,将导管末端插入水中,加热烧瓶,导管口有气泡产生,停止加热,导管内形成一段高于液面的稳定水注,则气密性好 < 吸收尾气Cl2、SO2,防止环境污染,同时防止空气中的水蒸气进入引起磺酰氯水解 c 蒸馏 SO2Cl2+4OH-=2Cl-+SO42-+2H2O 取少量w于试管中,加入足量Ba(NO3)2溶液,静置,向上层清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则w中存在Cl- SO2Cl2+2e-=SO2↑+2Cl-
【解析】(1)检验己装置气密性的方法是:关闭分液漏斗活塞,将导管末端插入水中,加热烧瓶,导管口有气泡产生,停止加热,导管内形成一段高于液面的稳定水注,则气密性好;
(2)根据装置图可知,蛇形冷凝管的作用是冷凝回流而反应又没有加热,故SO2与氯气间的反应为放热反应,由于会有一部分Cl2、SO2通过冷凝管逸出,故C中应使用碱性试剂,又因SO2Cl2遇水易水解,故碱石灰是用于吸收氯气、SO2并防止空气中的水蒸气进入B中;
(3)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,所以用c.60%H2SO4+K2SO3来制备SO2,故选c;
(4)分离沸点不同的液体可以用蒸馏的方法,所以丙中混合物分离开的实验操作是蒸馏;
(5)①SO2Cl2中加入足量NaOH溶液,使之水解,所得溶液中含有SO42-和Cl-,发生反应的离子方程式为SO2Cl2+4OH-=2Cl-+SO42-+2H2O;
②取少量w于试管中,加入足量Ba(NO3)2溶液,静置,向上层清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则w中存在Cl-;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑。