题目内容
【题目】碱式碳酸镁可用于牙膏、医药化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度。某兴趣小组设计了如下几个方案:
方案1
取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度

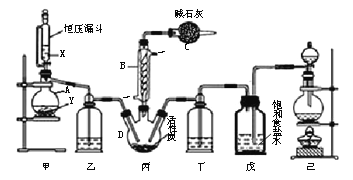
(1)乙中发生反应的方程式为______________________________ 。
(2)仪器接口的连接顺序为(装置可以重复使用) a___________,丁的作用是__________________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是______________________________。
方案Ⅱ
①称取碱式碳酸镁样品mg;②将样品充分高温燃烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g(用托盘天平称量)。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_________________________。
(6)有同学认为方案Ⅱ高温燃烧的过程中会发生![]()
会导致测定结果有误,你任为这位同学的观点正确吗?_________,(填“正确”或“错误”)
请说明自己的理由:______________________。
【答案】 4MgCO3·Mg(OH)2·5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑ debcb 除去CO2中的水蒸气 打开止水夹K,缓慢通入空气 E 样品连续两次高温煅烧,冷却称量质量相差0.1g以内 错误 该反应的发生不影响生成CO2和水蒸气的量。
【解析】 (1)乙中4MgCO3·Mg(OH)2·5H2O与硫酸反应生成硫酸镁、二氧化碳和水,反应的化学方程式为4MgCO3·Mg(OH)2·5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑,故答案为:4MgCO3·Mg(OH)2·5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑;
(2) 根据实验目的,通过测定CO2的质量计算纯度,反应生成的二氧化碳中混有水蒸气,需要用浓硫酸的洗气瓶除去,然后用碱石灰吸收生成的二氧化碳,为了防止外界空气中的水蒸气和二氧化碳加入装置,需要在最后连接一个干燥装置,因此仪器接口的连接顺序为a debcb,其中丁的作用是除去CO2中的水蒸气,故答案为:debcb;除去CO2中的水蒸气;
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确,应该用不含有二氧化碳的空气将装置中的二氧化碳全部赶出,因此操作为打开止水夹K,缓慢通入空气,故答案为:打开止水夹K,缓慢通入空气;
(4)根据方案Ⅱ的步骤,将样品充分高温燃烧,用到酒精灯、三脚架、泥三角、坩埚,冷却后称量,用到干燥器,不会用到的仪器是蒸发皿,故选E;
(5) 样品连续两次高温煅烧,冷却称量质量相差0.1g以内,说明样品完全分解,故答案为:样品连续两次高温煅烧,冷却称量质量相差0.1g以内;
(6)根据反应![]() 可知,反应过程中的二氧化碳和水蒸气的量不变,对测定结果无影响,故答案为:错误;该反应的发生不影响生成CO2和水蒸气的量;
可知,反应过程中的二氧化碳和水蒸气的量不变,对测定结果无影响,故答案为:错误;该反应的发生不影响生成CO2和水蒸气的量;

 同步练习强化拓展系列答案
同步练习强化拓展系列答案