题目内容
下列变化中涉及化学变化的是
(1)爆竹燃放(2)碘的升华(3)金属钝化(4)铝热反应(5)橡胶老化(6)甘油加水作护肤剂(7)蜂蚁蛰咬皮肤后涂稀氨水(8)医用酒精可用于皮肤消毒(9)烹鱼时加入少量的料酒和食醋(10)用四氯化碳可擦去圆珠笔油渍.
- A.(3)(4)(5)(6)(7)
- B.(2)(4)(5)(9)(10)
- C.(2)(5)(6)(8)(9)
- D.以上三个选项均不正确
分析:化学变化是指在原子核不变的情况下,有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别在于是否有新物质生成.
解答:(1)爆竹燃放的过程中一般有二氧化碳等物质生成,属于化学变化;
(2)碘的升华没有新物质生成,属于物理变化;
(3)金属钝化的过程中有新物质金属氧化物生成,属于化学变化;
(4)铝热反应的过程中有新物质金属铁生成,属于化学变化;
(5)橡胶老化的过程中,大分子变为小分子,属于化学变化;
(6)甘油加水作护肤剂没有新物质生成,属于物理变化;
(7)蜂蚁蛰咬皮肤后涂稀氨水的过程中有新物质生成,属于化学变化;
(8)医用酒精用于皮肤消毒的过程中有新物质生成,蛋白质发生了变性,属于化学变化;
(9)烹鱼时加入少量的料酒和食醋的过程中有新物质酯生成,属于化学变化;
(10)用四氯化碳擦去圆珠笔油渍的过程中没有新物质生成,属于物理变化.
故选D.
点评:解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化,如果有新物质生成就属于化学变化.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是:
,
溶液中各离子浓度大小的关系是 。
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
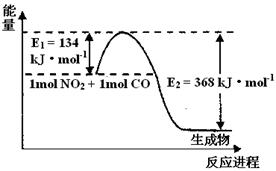
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1_ K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正_ _ v(N2)逆(填写“>”、“=”或“<”)
(12分)I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
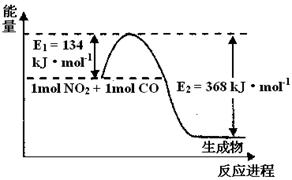
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)
 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2.H2的物质的量分别为1mol和2mol.3mol时,则该反应的v(N2)正_ _ v(N2)逆(填写“>”.“=”或“<”)
 I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).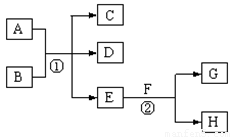
 Ti
Ti
 CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)