题目内容
【题目】按要求填空
(1)在配制一定体积的溶液中,下列操作使得到的溶液浓度偏高、偏低还是无影响?
①将溶解溶质的烧杯内的液体倒入容量瓶后,未洗涤烧杯就进行定容。_______
②定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸
出___________
③定容摇匀后,发现瓶内液面略低于瓶颈刻度线。______________
④配置稀硫酸时,若所用的浓硫酸长时间放置在密封不好的容器中,将使溶液浓度______________
(2)认装置如图,并填空:
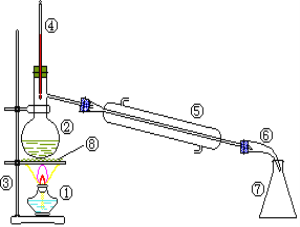
写出装置中各仪器的名称(编号和名称要对应):
②_______________、⑤_______________。实验时要在②中加入__________________,防止_______________。
【答案】偏低偏低无影响偏低蒸馏烧瓶直形冷凝管(冷凝管)碎瓷片(沸石)受热不均发生爆沸
【解析】
(1)①、将溶解溶质的烧杯内的液体转移进容量瓶后,未洗涤烧杯就进行定容,会导致n减小,溶液浓度偏低;
②、定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸出,也会吸出溶质,会导致n减小,溶液浓度偏低;
③、定容摇匀后,发现瓶内液面略低于瓶颈刻度线,对实验结果无影响;
④、配制稀硫酸时,若所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸能够吸水,将使溶液浓度偏低;
综上所述,本题答案是:偏低 ,偏低, 无影响, 偏低。
(2)这是一套蒸馏装置,装置中②为蒸馏烧瓶,⑤为直形冷凝管(冷凝管);实验时要在②中加入碎瓷片(沸石),防止液体受热不均发生爆沸现象;综上所述,本题答案是:蒸馏烧瓶 , 直形冷凝管(冷凝管), 碎瓷片(沸石),受热不均发生爆沸。

 名校课堂系列答案
名校课堂系列答案【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:

资料a: Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH见下表(金属离子的起始浓度为0.1 mol·L-1)
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是__________________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入黄色K3[Fe(CN)6](铁氰化钾)溶液,无明显变化:另取少量滤液1于试管中,___________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:i.2Fe2++Cl2=2Fe3++2Cl-
ii.4Fe2++O2+4H+=4Fe3++2H2O iii.……
写出iii的离子方程式:___________________________。
(2)过程II的目的是除铁,有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ii.焙烧法:将滤液1浓缩得到的固体于290°C焙烧,冷却,取焙烧物……
己知:焙烧中发生的主要反应2FeCl3+3O2=2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在 _______________之间。
②补全ii中的操作:____________________。
③两种方法比较,氨水法除铁的缺点是_________________________________________。
(3)过程III的目的是除铅。加入的试剂是______________________。
(4)过程IV所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=________________________。
