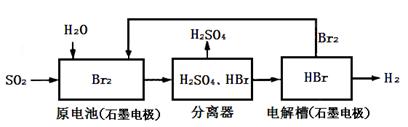
题目内容
铅蓄电池是最常用的化学电源,它在放电、充电时的电池反应为:
试回答:
(1)铅蓄电池负极的电极材料是_______。
(2)工作时铅蓄电池正极的电极反应是___________。
(3)铅蓄电池工作过程中,电解质溶液的密度会_______(填“减小”“增大”或“不变”,下同),pH________。
(4)该铅蓄电池在充电时阳极的电极反应是___________。
(5)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解前硫酸溶液浓度为4.5mol.L-1,当制得26.88LCl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。

试回答:
(1)铅蓄电池负极的电极材料是_______。
(2)工作时铅蓄电池正极的电极反应是___________。
(3)铅蓄电池工作过程中,电解质溶液的密度会_______(填“减小”“增大”或“不变”,下同),pH________。
(4)该铅蓄电池在充电时阳极的电极反应是___________。
(5)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解前硫酸溶液浓度为4.5mol.L-1,当制得26.88LCl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
(1)Pb (或铅)
(2)PbO2+4H++SO42-+2e-= PbSO4+2H2O
(3)减小、增大
(4)PbSO4+2H2O—2e-= PbO2+4H++SO42-
(5)1.5mol.L-1
(2)PbO2+4H++SO42-+2e-= PbSO4+2H2O
(3)减小、增大
(4)PbSO4+2H2O—2e-= PbO2+4H++SO42-
(5)1.5mol.L-1
试题分析:(1)铅蓄电池负极是失电子的一极,正极是得电子的一极,根据原电池总反应可判断其电极材料是Pb (或铅)。
(2)电池正极的电极反应是PbO2+4H++SO42-+2e-= PbSO4+2H2O 。
(3)根据总电极反应,由于硫酸溶液浓度减小,故电解质溶液的密度会减小。pH_增大。
(4)该铅蓄电池在充电时外界电源与原电池的正极相连,阳极的电极发生的反应氧化反应即失电子,电极反应为PbSO4+2H2O—2e-= PbO2+4H++SO42- 。
(5)电解前铅蓄电池中硫酸溶液的物质的量为3.6mol.,26.88LCl2时(指在标准状况下)物质的量为1.2mol,转移电子的物质的量是2.4mol。根据电子守恒,消耗硫酸2.4mol,硫酸还剩下1.2mol,因此电解后电池中硫酸溶液的浓度为1.2/0.8="1.5" mol.L-1。

练习册系列答案
相关题目
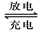 2PbSO4+2H2O
2PbSO4+2H2O

 VO2++2H++V2+。下列叙述正确的是 ( )
VO2++2H++V2+。下列叙述正确的是 ( )