题目内容
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入5 mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法正确的是


| A.溶液中结合OH-能力最强的离子是NH4+ |
| B.D点时溶液中存在:c(NH4+)+c(H+)=c(OH-)+c(NO3-) |
| C.合金中n(Fe) :n(Al)=1 :3 |
| D.C的值为7 |
D
试题分析:铁铝合金与足量很稀的硝酸充分反应,没有气体放出,这说明硝酸的还原产物应该是NH4+。根据图像可知加入的氢氧化钠溶液应先与过量的硝酸反应,然后再结合Fe3+、Al3+生成氢氧化铁和氢氧化铝沉淀。当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,这说明OH-与NH4+发生了反应,因此随着NaOH的滴加,发生的反应依次为①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH) 3↓,③NH4++OH-═NH3?H2O,④Al(OH) 3+OH-=AlO2-+2H2O。A、溶液中结合OH-能力最强的离子是H+,A不正确;B、根据电荷守恒可知,D点时溶液中存在:c(NH4+)+c(H+) +c(Na+)=c(OH-)+c(NO3-),B不正确;C、由图可知,EF段消耗的氢氧化钠的体积为36mL-34m=2mL,故该阶段参加反应的氢氧化钠为0.002L×5mol/L=0.010mol。根据Al(OH) 3+OH-=AlO2-+2H2O 、Al3++3OH-=Al(OH) 3↓可知,与Al3+反应的氢氧化钠是0.010mol×3=0.030mol,氢氧化铝的物质的量是0.010mol,则金属铝的物质的量也是0.010mol。DE段消耗的氢氧化钠的体积为34mL-31m=3mL,故该阶段参加反应的氢氧化钠为0.003L×5mol/L=0.015mol。根据NH4++OH-═NH3?H2O可知,n(NH4+)=0.015ml,所以根据电子得失守恒可知3n(Fe)+3×0.010mol=8×0.015mol,解得n(Fe)=0.030mol,所以合金中n(Fe) :n(Al)=3 :1,C不正确;D、滴加NaOH体积为31ml时,发生反应为①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH) 3↓,所以C点氢氧化钠溶液的体积为31ml-
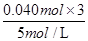 ×103ml/L=7mL,D正确,答案选D。
×103ml/L=7mL,D正确,答案选D。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目