题目内容
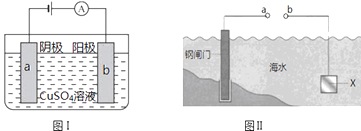
【题目】铜锌原电池(如图)工作时,下列叙述不正确的是( ) 
A.负极反应为:Zn﹣2e﹣═Zn2+
B.电池反应为:Zn+Cu2+═Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
【答案】D
【解析】解:A.锌较活泼,形成原电池反应使为原电池负极,被氧化,电极方程式为Zn﹣2e﹣═Zn2+ , 故A正确;B.负极反应式为 Zn﹣2e﹣=Zn2+、正极反应式为Cu2++2e﹣=Cu,得失电子相等时,正负极电极反应式相加即得电池反应式,所以电池反应为Zn+Cu2+═Zn2++Cu,故B正确;
C.负极上失电子,正极上得电子,外电路中,电子从负极沿导线流向正极,故C正确;
D.原电池工作时,阳离子向正极移动,故D错误.
故选D.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目