题目内容
【题目】“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:
C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.4kJ/mol
CO(g)+H2(g)ΔH=+131.4kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
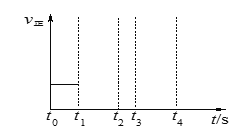
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
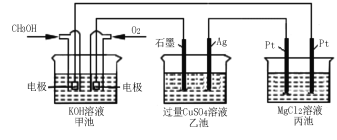
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
【答案】(1)0.002mol∕L·min(2)ABC
(3)
(4)CH3OH(l)+O2(g)=CO(g)+2H2O(g)ΔH=-354.8kJ∕mol
(5)2Cu2++2H2O![]() 2Cu+O2+4H+;34.8
2Cu+O2+4H+;34.8
【解析】
试题分析:(1)5min后容器内气体的密度增大了0.12g/L,因此气体的质量增加了0.12g/L×3L=0.36g,根据方程式可知:

所以消耗水蒸气的物质的量浓度是0.03mol÷3L=0.01mol/L,因此用H2O表示0~5miin的平均反应速率为0.01mol/L÷5min=0.002mol/(L·min)。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A容器中CO的体积分数保持不变,说明反应得到平衡状态,A正确;正逆速率比等于系数比,v正(H2O)= v正(H2)一定平衡,B正确;c.生成物CO(g)和H2(g)的平均相对分子质量为15,反应前气体只有水,反应前后相对分子质量不同,容器中混合气体的平均相对分子质量保持不变一定平衡,C正确;(3)①缩小容器体积,体系中浓度变大,v正、v正突然变大,平衡逆向移动,v正再有变大的趋势,t2时到达平衡。②t3时平衡常数K值变大,说明改变条件是升高温度,v正、v正突然变大,平衡正向移动,v正再有变小的趋势,t4到达平衡;
(4)根据燃烧热的定义,为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发热为44.0 kJ/mol,则热化学方程式①CH3OH (l) +![]() O2 (g) =CO2 (g) + 2H2O (l) ΔH=-725.8 kJ ∕ mol ②CO (g) +
O2 (g) =CO2 (g) + 2H2O (l) ΔH=-725.8 kJ ∕ mol ②CO (g) +![]() O2 (g) =CO2 (g) ΔH=-283.0 kJ∕mol ③H2O (l)= H2O (g) ΔH=+44.0 kJ∕mol;根据盖斯定律①-②+③×2得CH3OH (l) + O2 (g) =CO (g) + 2H2O (g) ΔH=-354.8 kJ ∕ mol;(5)乙池为电解池,石墨是阳极,发生反应的离子方程式为2Cu2++2H2O
O2 (g) =CO2 (g) ΔH=-283.0 kJ∕mol ③H2O (l)= H2O (g) ΔH=+44.0 kJ∕mol;根据盖斯定律①-②+③×2得CH3OH (l) + O2 (g) =CO (g) + 2H2O (g) ΔH=-354.8 kJ ∕ mol;(5)乙池为电解池,石墨是阳极,发生反应的离子方程式为2Cu2++2H2O![]() 2Cu+O2+4H+;甲池中发生的反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,溶液中甲醇和氧气反应后导致溶液质量增大,每反应2mol甲醇和3mol氧气反应溶液质量增加=2mol×32g/mol+3mol×32g/mol=160g,电子转移为12mol,当甲池中增重16g时,电子转移1.2mol,电子守恒得到丙池中理论上产生沉淀为氢氧化镁质量,MgCl2+2H2
2Cu+O2+4H+;甲池中发生的反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,溶液中甲醇和氧气反应后导致溶液质量增大,每反应2mol甲醇和3mol氧气反应溶液质量增加=2mol×32g/mol+3mol×32g/mol=160g,电子转移为12mol,当甲池中增重16g时,电子转移1.2mol,电子守恒得到丙池中理论上产生沉淀为氢氧化镁质量,MgCl2+2H2![]() OMg(OH)2↓+H2↑+Cl2↑。电子转移1.2mol,生成氢氧化镁0.6mol,质量为0.6mol×58g/mol=34.8g
OMg(OH)2↓+H2↑+Cl2↑。电子转移1.2mol,生成氢氧化镁0.6mol,质量为0.6mol×58g/mol=34.8g

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案