题目内容
【题目】认真观察图中装置,回答下列问题:
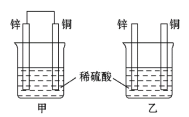
(1)下列说法中正确的是_________(填序号)。
a.甲中铜片质量减少 b.乙中锌片质量减少
c.乙中铜片上没有明显变化 d.甲装置为原电池,乙装置为电解池
(2)同等条件下,两烧杯中产生气泡的速率:甲______(填“>”“<”或“=”)乙。
(3)甲烧杯中锌电极为_______(正极或负极),写出铜极的反应电极方程式_______。
(4)当甲中产生2.24 L(标准状况)气体时,理论上通过导线的电子数目为_______mol。
【答案】bc > 负 2H++2e-=H2↑ 0.2
【解析】
(1)根据原电池构成条件及反应原理分析解答;
(2)原电池反应可以加快反应速率;
(3)活动性强的电极为负极,负极失去电子,发生氧化反应;活动性弱的电极为正极,正极上溶液中的H+得到电子被还原产生H2;
(4)根据同一闭合回路中电子转移数目相等,结合物质的量的有关计算公式计算。
(1)a.甲构成了原电池,Cu活动性比Zn弱,为正极,正极上溶液中的H+得到电子被还原产生H2,Cu电极本身不参加反应,因此甲中铜片质量不变,a错误;
b.在金属活动性顺序表中Zn位于H的前边,可以与酸发生置换反应而被氧化,因此锌的质量会不断减少,b正确;
c.Cu的活动性比H弱,因此不能与酸发生反应,所以乙中铜片上没有明显变化,c正确;
d. 甲装置具备原电池构成条件,形成了原电池,乙装置没有形成闭合回路,也没有电源,因此既没有构成原电池,也没有形成电解池,d错误;
故合理选项是bc;
(2)甲装置构成了原电池,Zn为负极,失去电子,被氧化变为Zn2+;Cu活动性弱,为原电池的正极,正极上溶液中的的H+得到电子被还原产生H2,原电池反应加快了放出氢气的速率,而乙装置没有形成原电池,因此同等条件下,两烧杯中产生气泡的速率:甲>乙;
(3)甲烧杯中形成原电池,由于金属活动性Zn>Cu,锌电极为负极,失去电子被氧化;铜为正极,正极上溶液中的的H+得到电子被还原产生H2,电极反应式为:2H++2e-=H2↑;
(4)2.24 L标准状况下的氢气的物质的量n(H2)=![]() =0.1 mol,根据电极反应式2H++2e-=H2↑可知:每反应产生1 mol H2,转移2 mol电子,则产生0.1 mol H2时转移电子的物质的量是0.2 mol。
=0.1 mol,根据电极反应式2H++2e-=H2↑可知:每反应产生1 mol H2,转移2 mol电子,则产生0.1 mol H2时转移电子的物质的量是0.2 mol。