题目内容
9.铅蓄电池的充、放电反应方程式为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.关于铅蓄电池的说法正确的是( )| A. | 放电时,正极发生的反应是:Pb(s)+SO${\;}_{4}^{2-}$(aq)-2e-═PbSO4(s) | |
| B. | 充电时,每消耗1molPbSO4的同时转移2mol电子 | |
| C. | 放电时,该电池的负极材料是铅板 | |
| D. | 充电时,电池中硫酸的浓度不断变小 |
分析 由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,放电时,阴离子向负极移动,阳离子向正极移动,以此解答该题.
解答 解:A.正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故A错误;
B.根据总的电池反应,得到充电时每消耗1molPbSO4的同时转移1mol电子,故B错误;
C.由总方程式可知,为原电池时,Pb为负极,发生氧化反应,故C正确.
D.由方程式可知,充电时,消耗水,生成硫酸,电解质溶液中硫酸浓度增大,故D错误;
故选C.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意把握电解方程式的书写,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
19.氟氧酸是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O=HOF+HF.该反应中水的作用与下列反应中水的作用相同的是( )
| A. | 钠与水反应制氢气 | B. | 过氧化钠与水反应制氧气 | ||
| C. | 氯气与水反应制次氯酸 | D. | 氟单质与水反应制氧气 |
20.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 将1molFeCl3水解制成胶体,所得胶体的胶粒数为NA | |
| C. | 0.5mol NH4HSO4晶体中,含有H+数目为0.5NA | |
| D. | 18gD2O含有的电子数为10NA |
4.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol Cl2完全反应转移的电子数一定是2NA | |
| B. | 标准状况下,22.4 L CCl4中含有的分子数为NA | |
| C. | 1 L 0.1 mol•L-1乙醇溶液中含有的氧原子数为0.1NA | |
| D. | 4 g氦气中含有的分子数和原子数均为NA |
1..下列有关化学用语表示正确的是( )
| A. | CH4分子的球棍模型: | |
| B. | 中子数为146、质子数为92的铀原子${\;}_{92}^{146}$U | |
| C. | 氟化钠的电子式: | |
| D. | 正丁烷的结构简式:C4H10 |
18.已知某铜、铁合金中铜和铁的物质的量之和为amol,其中Cu的物质的量分数为b,将其全部投入到50mL c mol•L-1的硝酸溶液中,加热使HNO3完全反应(假设NO是唯一的还原产物).则下列说法正确的是( )
| A. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| B. | 若金属有剩余,向溶液中再滴入硫酸后,金属不会发生溶解 | |
| C. | 当溶液中金属离子只含有Fe3+、Cu2+时,则c与a、b的关系为:c=80a$\frac{1-b}{3}$ | |
| D. | 若金属全部溶解,且产生336mL气体(标准状况),则c=0.3 |
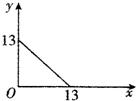 某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题:
某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题: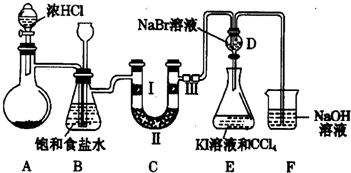
 已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)
已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)