题目内容
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,6.0g NO和2.24L O2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,0.1mol Na2O和Na2O2组成的混合物中,阴离子的数目为0.1NA | |
| C. | C2H4和C3H6的混合物的质量为mg,所含碳氢键的数目为$\frac{3m}{14}$NA | |
| D. | 1mol甲基( )所含的电子数为7NA )所含的电子数为7NA |
分析 A.标准状况下,2.24L O2的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol;
B.1molNa2O含有阴离子1mol,1molNa2O2含有1mol阴离子;
C.1molC2H4含有的碳氢键数目为4mol,1molC3H6含有的碳氢键数目为6mol;
D.1mol甲基含有的电子数为9mol.
解答 解:A.标准状况下,2.24L O2的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,6.0gNO的物质的量为$\frac{6.0g}{30g/mol}=0.2mol$,则6.0g NO和2.24L O2混合,所得气体的分子数目为0.1mol+0.2mol=0.3mol,即0.3NA,故A错误;
B.1molNa2O含有阴离子1mol,1molNa2O2含有1mol阴离子,二者无论按何种比例混合,0.1mol改混合物,阴离子数目都为0.1mol,即0.1NA,故B正确;
C.1molC2H4含有的碳氢键数目为4mol,1molC3H6含有的碳氢键数目为6mol,设mg混合物中,有xmolC2H4,ymolC3H6,由质量关系:28x+42y=m,含有的碳氢键数目为4x+6y=$\frac{m}{7}$mol,即$\frac{m}{7}{N}_{A}$,故C错误;
D.1mol甲基含有的电子数为9mol,即9NA,故D错误;
故选B.
点评 本题考查阿伏伽德罗常数的知识,注意标准状况,常温常压等对气体摩尔体积的影响.题目难度不大,是基础题.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
9.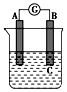 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A. | A是Zn,B是Cu,C为稀硫酸 | B. | A是Cu,B是Zn,C为稀硫酸 | ||
| C. | A是Cu,B是Fe,C为稀Cu(NO3)2溶液 | D. | A是Fe,B是Ag,C为稀AgNO3溶液 |
11.1mg锎(25298Cf)每秒种能释放2.34×109个中子,其在医学上常被用作治疗恶性肿瘤的中子源.下列有关说法错误的是( )
| A. | 锎位于元素周期表第七周期 | |
| B. | 1 mg锎(25298Cf)中含有2.34×109个中子 | |
| C. | 25298Cf原子中,质子数和核外电子数均为98 | |
| D. | 25298Cf的中子数与质子数之差为56 |
8.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 1molFeBr2与足量的氯气反应时转移的电子数为2NA | |
| D. | 25℃时pH=11的Na2CO3溶液中水电离出的OH-的数目为0.001NA |
15.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 砒霜的主要成分是三硫化二砷 | |
| B. | 水分子间的氢键是一种特殊的化学键 | |
| C. | 过量服用阿司匹林引起酸中毒后,可用静脉注射NaHCO3溶液的方法解毒 | |
| D. | 铜单质制成的“纳米铜”在空气中能燃烧,说明“纳米铜”的金属性比铜片强 |
10. 如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol•L-1,温度为T1时Ca(OH)2的Ksp=4×10-6,$\root{3}{4}$≈1.6].下列说法正确的是( )
如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol•L-1,温度为T1时Ca(OH)2的Ksp=4×10-6,$\root{3}{4}$≈1.6].下列说法正确的是( )
 如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol•L-1,温度为T1时Ca(OH)2的Ksp=4×10-6,$\root{3}{4}$≈1.6].下列说法正确的是( )
如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol•L-1,温度为T1时Ca(OH)2的Ksp=4×10-6,$\root{3}{4}$≈1.6].下列说法正确的是( )| A. | 温度:T1<T2 | |
| B. | 温度为T1时,P点分散系中分散质粒子直径均小于1nm | |
| C. | Q点的溶液中c(OH-)约为0.0125mol•L-1 | |
| D. | 加水稀释时溶液碱性减弱,Z点溶液可转化为Q点溶液 |
8.一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关反应的说法正确的是
( )
( )
| A. | 反应中MnO2是还原剂 | |
| B. | 电池工作时,海水起导电作用,其中NaCl浓度保持不变 | |
| C. | Ag为负极,电极反应为Ag-e-+Cl-=AgCl | |
| D. | 每生成1 mol Na2Mn5Ol0转移1mol电子 |
