题目内容
可逆反应A+a B  C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
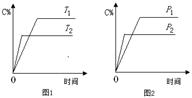
A.T2>T1,p2>p1
B.该反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应的?H增大
 C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
A.T2>T1,p2>p1
B.该反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应的?H增大
D
试题分析:A、根据反应速率的大小确定温度和压强的大小,根据图1,T2时反应速率大,所以T2>T1,根据图2,p2反应速率大,所以p2>p1,正确;B、根据图1,温度升高,C的百分含量减小,平衡向左移动,所以该反应为放热反应,正确;C、压强变大,C的百分含量减小,平衡向左移动,逆反应方向气体系数减小,说明A为液态或固态,正确;D、?H与反应物的量无关,增加B的物质的量,该反应的?H不变,错误。

练习册系列答案
相关题目

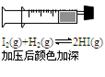




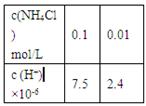
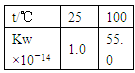
 C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度 N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是 2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )
2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )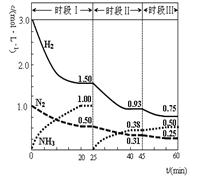
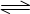 R(g)+S(g)在恒温下已达到平衡是
R(g)+S(g)在恒温下已达到平衡是 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的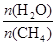 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: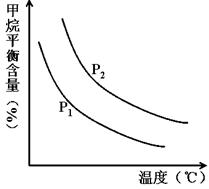
 2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是