题目内容
(12分)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
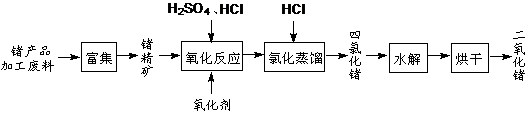
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)
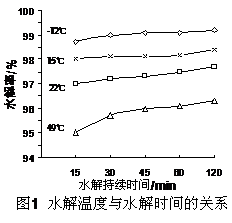
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率

(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)

A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
(1)Ge2++H2O2+2H+=Ge4++2H2O (2)抑制GeCl4水解
(3)GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HC1 C
(4)二氧化锗具有两性, GeO2+2OH-=GeO+H2O
(3)GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HC1 C
(4)二氧化锗具有两性, GeO2+2OH-=GeO+H2O
(1)根据氧化还原反应的本质:锗的失去电子,化合价上升;则氧得到电子,化合价下降生成水。再根据化学反应前后原子守恒,可配平化学反应:Ge2++H2O2+2H+=Ge4++2H2O
(2)-(3):由于GeCl4强酸弱碱盐,在加热的很容更易发生水解反应,即
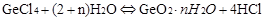 ,当加入浓盐酸可以抑制反应向右进行,即抑制水解。温度越低越不利于水解反应,冰盐水可以降低冰的凝固点,使温度更低。所以选C。
,当加入浓盐酸可以抑制反应向右进行,即抑制水解。温度越低越不利于水解反应,冰盐水可以降低冰的凝固点,使温度更低。所以选C。(4)锗的对角是铝,氧化铝是两性金属氧化物,既可以与酸反应,又可以与碱反应。所以氧化锗是两性氧化物,既可以与酸反应,又可以与碱反应,且酸碱性越强反应越剧烈。当pH>8时,生成偏锗酸盐和水,即GeO2+2OH-=GeO32-+H2O。

练习册系列答案
相关题目
 酸性氧化物也不属于碱性氧化物的是( )
酸性氧化物也不属于碱性氧化物的是( )