题目内容
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe.3H2O,Mr=288)是一种常用的补铁剂,可通过是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
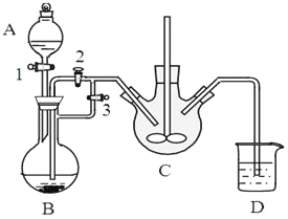
回答下列问题:
(1)NH4HCO3盛放在装置 中(填字母),该装置中涉及的主要反应的离子方程式____________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是________,
反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,高锰酸钾标准液用_________滴定管盛装(填“酸式”或“碱式”)。下列操作会引起测定结果偏高的是_________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
(5)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁的质量分数为 。
【答案】(1) 装置C(1分)) Fe2+ +2HCO3-=FeCO3↓+CO2↑+H2O (2分)
(2) (待D的气体纯净后)关闭活塞3、打开活塞2 (2分)
(3) 防止+2价的铁元素被氧化 (2分) 加入适量乳酸让铁粉反应完全 (2分)
(4)酸式 (2分) A D(2分,对一个计1分,有错计2分) (5) 98.50% (2分)
【解析】
试题分析:(1)装置B是铁盒盐酸反应生成氯化亚铁,在装置C中氯化亚铁与碳酸氢铵反应生成碳酸亚铁。离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,因此NH4HCO3盛放在装置C中。
(2)装置B中铁和盐酸反应生成氯化亚铁盒氢气,先将氢气排除装置C的空气,防止碳酸亚铁被空气中的氧气氧化,待最后的导管口气体纯净后,关闭关闭活塞3、打开活塞2,利用气体压强,将氯化亚铁溶液压入装置C中,与碳酸氢铵反应。
(3)因为亚铁易被氧化成铁离子,加入铁粉,防止+2价的铁元素被氧化;铁粉过量时可以加入适量乳酸让铁粉反应完全。
(4)高锰酸钾标准液具有强氧化性和酸性,用酸式滴定管盛装。A.滴定管在盛装高锰酸钾前未润洗,导致标准液浓度减小,消耗标准液体积增加,测定结果偏高;B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出,导致消耗标准液体积减小,测定结果偏低;C.滴定前读数正确,滴定终点时俯视读数,读数偏小,导致消耗标准液体积减小,测定结果偏低;D.滴定前读数正确,滴定终点时仰视读数,读数偏大,导致消耗标准液体积增加,测定结果偏高;答案选AD。
(5)亚铁离子的物质的量为0.1000mol/L×0.01970L×5=0.00985mol,乳酸亚铁的质量分数=0.00985mol×288g/mol/2.880g×100%=98.50%。

【题目】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是: 在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目:___________________
当有0.2molKIO3与足量的KI反应时氧化剂与还原剂的物质的量之比是___ _____,转移的电子数目为 _ _ ___
(2)实验结束后分离I2和K2SO4溶液所用的方法是 ,所用的分离试剂是 ,所用的玻璃仪器有 .
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的稀硫酸溶液450mL,需量取98%的浓硫酸(其密度为1.84g/cm3)的体积为 ml,配制中需要用到的主要玻璃仪器有烧杯、玻璃棒、胶头滴管 .
(4)下面操作造成所配稀硫酸溶液浓度偏小的是_____________(填序号)
A.溶解的时候溶液没有冷却到室温就转移 |
B.转移时没有洗涤烧杯、玻璃棒 |
C.向容量瓶加水定容时眼睛俯视液面 |
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶 |
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线