题目内容
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、K1O3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
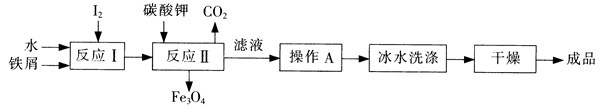
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 ,
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
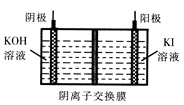
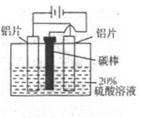
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:

①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 ,
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。

(1)①Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑
②加热浓缩、冷却结晶、过滤 洗涤除去表面可溶性杂质,同时减少KI的溶解损失
(2)①在较高温度下K1O3易分解 ②1700 ③I一+3H2O
 IO3一+3H2↑ 增大
IO3一+3H2↑ 增大(每空2分,本题共14分)
试题分析:工业流程题,(1)①根据化合物中铁元素与碘元素的质量比为21:127计算出原子个数比,得出化学式Fe3I8,根据反应物和产物书写化学方程式;②从溶液中分离晶体一般采用降温结晶法,滤液一般为稀溶液,故要浓缩,所以操作为加热浓缩、冷却结晶、过滤;洗涤的目的是除去表面杂质,冰水、相应饱和溶液、乙醇等均是减少晶体的溶解损失;(2)①在较高温度下K1O3易分解;②反应方程式为 5H2O2+I2=2HIO3+4H2O HIO3+KOH=KIO3+H2O,
n(H2O2)=5/2n(KIO3)=15×103mol,m(H2O2)=15×103×34÷30%=1.7×106g=1700kg
③根据图示可知,阳极:5OH-+I—-5e- =IO3? + H2O,阴极:2H++2e- =H2↑,故总方程式为I-+3H2O
 IO3-+3H2↑;电解过程中氢离子放电,溶液中OH-浓度增大,pH增大。
IO3-+3H2↑;电解过程中氢离子放电,溶液中OH-浓度增大,pH增大。
练习册系列答案
相关题目
 Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是: 2Ni(OH)2。根据此反应式,下列 有关说法中正确的是:
2Ni(OH)2。根据此反应式,下列 有关说法中正确的是: 
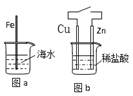
 3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
 转变为
转变为  时,碳原子要向外界环境吸收能量
时,碳原子要向外界环境吸收能量