题目内容
【化学——物质结构与性质】
氮及其化合物在生活生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着 个σ键和 个π键;
(3)磷、氨、氧是周期表中相邻的三种元素,比较:
①氮原子的第一电离能 (填“大于”、“小于”或“等于”)氧原子的第一电离能;
②N2分子中氮氮键的键长 (填“大于”、“小于”或“等于”)白磷分子中磷磷键的键长;
(4)氮元素的氢化物——NH3是一种易液化的气体,氨分子中氮原子杂化类型为 杂化,该气体易液化的原因是 。
(1)2s22p3(2)一个σ键,二个π键
(3)大于 小于(4)sp3杂化,有未成键的孤对电子能形成氢键
解析:
(1)对于主族元素来说,价电子排布实际上就是最外层电子排布,故N的价电子排布为2s22p3。
(2)p轨道夹角为90°,因此两N原子间成键只有一个p轨道“顶头”成键,另外两个轨道“平行”成键,故形成一个σ键,二个π键。
(3)①氮原子的最外层s轨道全充满,p轨道为半充满,比较稳定,而氧原子的p轨道失去一个电子成为较稳定的半充满状态,因此N的第一电离能大于O的第一电离能;②氮原子的半径小于P原子的半径,且N2分子中形成的是叁键,白磷中P-P键为单键,故氮分子中的氮氮键键长小于白磷中的磷磷键键长。
(4)根据氨分子的键角,可以判断,氨分子中氮的杂化方式为sp3杂化,由于N的电负性较大,氮原子有未成键的孤对电子,分子间能形成氢键,故氨是一种易液化的气体。

练习册系列答案
相关题目

 (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】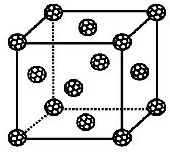 【化学-物质结构与性质】
【化学-物质结构与性质】