题目内容
下列解释实验事实的方程式正确的是
A.氨水中滴入酚酞溶液,溶液变红: NH3·H2O  NH4+ + OH— NH4+ + OH— |
B.90℃时,测得纯水中c(H+)·c(OH—) =3.8×10—13: H2O(l)  H+(aq) + OH—(aq) H+(aq) + OH—(aq) H<0 H<0 |
C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+ 2Fe2+ + SO42—+ 4H+ |
| D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O →2C6H5OH+Na2CO3 |
C
解析试题分析:A、一水合氨属于弱碱,部分电离,应用 符号表示,错误;B、常温时纯水中c(H+)·c(OH—) =1.0×10—14,温度升高,水的离子积增大,说明升温电离平衡正向移动,正向是吸热反应,
符号表示,错误;B、常温时纯水中c(H+)·c(OH—) =1.0×10—14,温度升高,水的离子积增大,说明升温电离平衡正向移动,正向是吸热反应, H>0,错误;C、FeCl3溶液中通入SO2,溶液黄色褪去,是因为二氧化硫与氯化铁发生了氧化还原反应,符合离子方程式的书写原则,正确;D、向苯酚钠溶液中通入CO2,应生成碳酸氢钠和苯酚,错误,答案选C。
H>0,错误;C、FeCl3溶液中通入SO2,溶液黄色褪去,是因为二氧化硫与氯化铁发生了氧化还原反应,符合离子方程式的书写原则,正确;D、向苯酚钠溶液中通入CO2,应生成碳酸氢钠和苯酚,错误,答案选C。
考点:考查离子方程式书写的判断

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
对于某酸性溶液(可能含有Br –、SO42 –、H2SO3、NH4+),分别进行如下实验: ①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。对于下列物质不能确定其在原溶液中是否存在的是
| A.Br – | B.SO42– | C.H2SO3 | D.NH4+ |
往某含有Na2CO3、NaAlO2的溶液中逐滴加入1 mol/L的盐酸,测得溶液中CO32-、HCO3-、AlO2-、Al3+的物质的量(n)与加入盐酸的体积(V)的变化关系如右图所示。下列说法不正确的是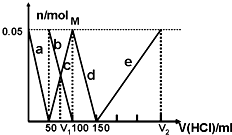
| A.a曲线表示的是溶液中A1O2-物质的量与加入盐酸的体积的变化关系 |
| B.该溶液中Na2CO3和NaAlO2物质的量相等 |
| C.M点处生成HCO3-物质的量为0.05 mol |
| D.V1:V2=1:5 |
下列离子方程式正确的是
| A.lmol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+ HCO3-=CaCO3↓+H2O |
| C.AlCl3溶液中加入过量氨水:Al3++4 OH-= AlO-2+2H2O |
| D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+= Ag++2NH4++ H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
下表中关于离子方程式评价合理的是
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 醋酸钠溶于水:CH3COO-+H2O===" " CH3COOH+OH- | 正确 |
| B | 在氢氧化钠溶液中滴加少量氯化铝: Al3++3OH-===Al(OH)3↓ | 错误,Al(OH)3能溶于氢氧化钠 |
| C | 铁加入到过量的稀硝酸溶液中:3Fe + 8H++2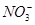 ===3Fe2++ 2NO↑ + 4H2O ===3Fe2++ 2NO↑ + 4H2O | 正确 |
| D | 在硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀的物质的量最多:3Ba2++6OH-+2Al3++3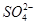 === 3BaSO4↓+2Al(OH)3↓ === 3BaSO4↓+2Al(OH)3↓ | 错误,Al3+与OH-的化学计量数之比为1∶3 |
下列图示与对应的叙述不相符的是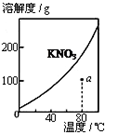
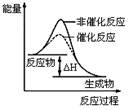

图1 图2 图3 图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液得到的滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
在下列溶液中,各组离子一定能够大量共存的是( )
| A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- |
B.常温下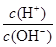 =1012的溶液:Fe2+、Mg2+、NO3-、Cl- =1012的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.含有大量Al3+的溶液:Na+、Cl-、AlO2-、OH- |
| D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
