题目内容
对于某酸性溶液(可能含有Br –、SO42 –、H2SO3、NH4+),分别进行如下实验: ①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。对于下列物质不能确定其在原溶液中是否存在的是
| A.Br – | B.SO42– | C.H2SO3 | D.NH4+ |
B
解析试题分析:①某酸性溶液加热时放出的气体可使品红溶液褪色;证明含有H2SO3;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;证明含有NH4+;③加入氯水时,溶液略呈橙红色,证明含有Br –。由于氯水有强氧化性,会把H2SO3氧化为H2SO4.产生了SO42 –;再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。证明该溶液中含SO42 –,但是不一定是原来溶液中含有的。不能确定其在原溶液中是否存在的是SO42–。选项是B。
考点:考查溶液成分及微粒鉴定的知识。

练习册系列答案
相关题目
在下列溶液中,各组离子一定能够大量共存的是
| A.常温下水电离出的c(OH-)=10-13的溶液中:Na+、ClO-、F-、K+ |
| B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- |
| C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH- |
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO 、S2-、SO 、S2-、SO |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.澄清透明的溶液中:H+、Fe2+、SO42-、NO3- |
| B.使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- |
| C.0.1 mol·L-1的BaCl2溶液中:K+、Na+、OH-、NO3ˉ |
| D.由水电离出的c(H+)=10-12 mol·L-1的溶液中:Mg2+、K+、Br-、HCO3- |
下列实验所对应的离子方程式正确的是( )
| A.向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3- |
| B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+ |
| C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O |
| D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-=Fe4[Fe(CN)6]2↓ |
下列离子方程式中正确的是
| A.在少量Mg(OH)2悬浊液中滴加氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ |
| B.双氧水中滴加2滴FeCl3溶液:Fe3++H2O2=Fe2++O2↑+2H+ |
| C.双氧水加入稀硫酸和KI溶液: H2O2+2H++2I—= I2+ O2↑+2 H2O |
| D.向银氨溶液中加入盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O |
已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g 水;
② 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的 ,
, ;
;
草酸( )的
)的 ,
,
③相同条件下电离出S2-的能力:FeS>H2S>CuS,以下离子方程式错误的是( )
| A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
B. |
C. |
D.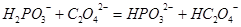 |
(6分)(2012?重庆)向10mL 0.1mol?L﹣1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL.下列叙述正确的是( )
A.x=10时,溶液中有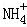 、Al3+、 、Al3+、 ,且c( ,且c( )>c(Al3+) )>c(Al3+) |
B.x=10时,溶液中有 、 、 、 、 ,且c( ,且c( )>c( )>c( ) ) |
C.x=30时,溶液中有Ba2+、 、OH﹣,且c(OH﹣)<c( 、OH﹣,且c(OH﹣)<c( ) ) |
| D.x=30时,溶液中有Ba2+、Al3+、OH﹣,且c(OH﹣)=c(Ba2+) |
揭示下列变化的离子方程式正确的是
| A.明矾用于净水:A3++3H2O=Al(OH)3↓+3H+ |
| B.钢铁吸氧腐蚀的负极反应:Fe-3e-=Fe3+ |
| C.向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓ |
D.苯酚钠饱和溶液中通入少CO2: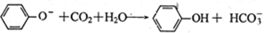 |
下列解释实验事实的方程式正确的是
A.氨水中滴入酚酞溶液,溶液变红: NH3·H2O  NH4+ + OH— NH4+ + OH— |
B.90℃时,测得纯水中c(H+)·c(OH—) =3.8×10—13: H2O(l)  H+(aq) + OH—(aq) H+(aq) + OH—(aq)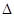 H<0 H<0 |
C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+ 2Fe2+ + SO42—+ 4H+ |
| D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O →2C6H5OH+Na2CO3 |