题目内容
【题目】某小组同学通过下列实验探究了物质的溶解度大小、反应物浓度与沉淀转化方向之间的关系。
已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g(20℃) |
|
|
|
|
(1)探究BaCO3和BaSO4之间的转化
实验操作:
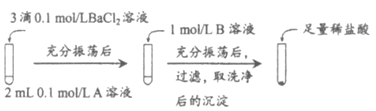
试剂A | 试剂B | 加入盐酸后的现象 | |
实验Ⅰ | Na2CO3 | Na2SO4 | 无明显现象 |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ中加入A溶液后生成沉淀的离子方程式为_____________。
②实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因________。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
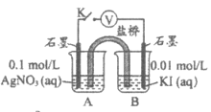
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| p>装置 | 步骤 | 电压表读数 |
| i. 如图连接装置并加入试剂,闭合K | a |
ii. 向B中滴入AgNO3(aq),至沉淀完全 | b | |
iii. 再向B中投入一定量NaCl(s) | c | |
iv. 重复i,再向B中加入与iii等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液是_____________(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
②实验Ⅳ中结合信息,解释电压b<a的原因:_____________。
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是_____________。
(3)综合实验Ⅰ~Ⅳ,下列说法正确的是_____________(填序号)。
a. 溶解度小的沉淀只能转化成溶解度更小的沉淀
b. 电化学是研究物质性质和转化的重要手段之一
c. 某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化
d. 溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现
【答案】Ba2++CO32-=BaCO3↓ BaSO4在溶液中存在BaSO4(s)Ba2+(aq)+SO42-(aq),当加入浓度较高的Na2CO3溶液,CO32-与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。 a 加入AgNO3后,生成AgI沉淀使B的溶液中c(I-)减小,I-还原性减弱,导致电压b<a 实验iv表明Cl-本身对该原电池电压无影响,则c>b说明加入Cl-使c(I-)增大,证明发生了:AgI+Cl-AgCl+I- bcd
【解析】
(1)①碳酸钠溶液中滴加氯化钡溶液生成碳酸钡沉淀,反应方程式为Ba2++CO32-=BaCO3↓;
②BaSO4在溶液中存在BaSO4(s)Ba2+(aq)+SO42-(aq),当加入浓度较高的Na2CO3溶液,CO32-与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。
(2)①实验Ⅲ中后最后加入的时0.1mol/L的KI溶液,应该是探究的是AgCl转化成AgI,加入的NaCl溶液应该过量,AgNO3溶液应该不足,根据图示可知,甲不足、乙过量,则甲溶液是AgNO3溶液,故选a;
②加入AgNO3后,生成AgI沉淀使B的溶液中c(I-)减小,I-还原性减弱,导致电压b<a;
③实验ⅳ表明Cl-本身对该原电池电压无影响,则c>b说明加入Cl-使c(I-)增大,证明发生了反应AgI+Cl-AgCl+I-,部分AgI转化为AgCl;
(3)a. 实验II和实验Ⅳ说明在一定条件下溶解度小的沉淀也可以转化成溶解度大的沉淀,故a错误;
b. 实验Ⅳ说明电化学是研究物质性质和转化的重要手段之一,故b正确;
c. 实验II和实验Ⅳ均表明某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化,故c正确;
d. 综合实验Ⅰ~Ⅳ可知:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现,故d正确;
综上所述选bcd。