题目内容
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据下图图示判断,下列说法正确的是
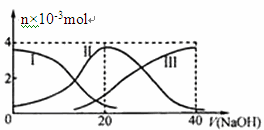

| A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>c(A2-)>c(OHˉ) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D.向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
A
试题分析:A、当V(NaOH)=20 mL时,酸和碱刚好反应生成NaHA,但此时H2A的浓度并不为0,而是以HAˉ、A2-、H2A三种形式存在,说明H2A为二元弱酸,从图像可知:c(HAˉ) > c(A2-) > H2A,说明HAˉ的电离程度大于水解程度,所以c(H+)>c(A2-)>c(OHˉ),结合电离理论分析,A正确;由于NaHA以电离为主,对水的电离有抑制作用,B错误;C、NaHA电离为主,水溶液成酸性,所以要加碱;D、NaHA水溶液成酸性,加水稀释氢离子浓度减小,pH增大。

练习册系列答案
相关题目
 )>c(NH
)>c(NH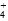 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)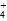 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-) 增大,可加入的物质是( )
增大,可加入的物质是( )