题目内容
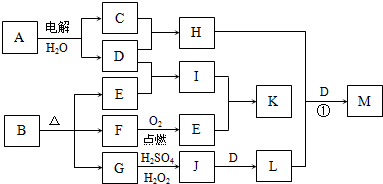
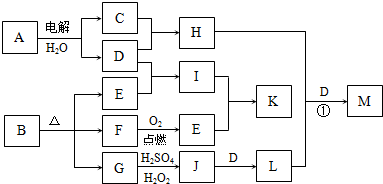
下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全.已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂.B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀.
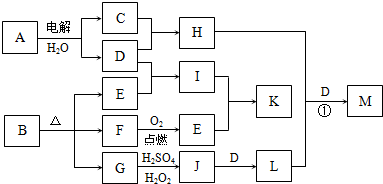
根据以上信息,回答下列问题:
(1)B的组成元素为 .
(2)鉴别等物质的量浓度的I、K稀溶液的实验方法为 .
(3)G→J的离子方程式为 .
(4)M是含氧酸盐,反应①中H、L、D的物质的量之比为3:2:4,则M的化学式为 .

根据以上信息,回答下列问题:
(1)B的组成元素为
(2)鉴别等物质的量浓度的I、K稀溶液的实验方法为
(3)G→J的离子方程式为
(4)M是含氧酸盐,反应①中H、L、D的物质的量之比为3:2:4,则M的化学式为
分析:A是食品调味剂,水溶液的电解产物H是消毒剂的有效成分,则A为NaCl,H为NaClO,G为氧化物,加H2SO4、H2O2生成J,J加D得L,L为红褐色沉淀,则L为Fe(OH)3,D为NaOH,以此逆推可知J为Fe2(SO4)3,G为FeO,则B中含有Fe元素,C为Cl2,B为有机酸盐,则一定含有C、O两元素,E、F为氧化物,结合框图,则F为CO,E为CO2,I为Na2CO3(纯碱),K为NaHCO3(小苏打),均可作食品的发泡剂,结合对应物质的性质以及题目要求解答该题.
解答:解:A是食品调味剂,水溶液的电解产物H是消毒剂的有效成分,则A为NaCl,H为NaClO,G为氧化物,加H2SO4、H2O2生成J,J加D得L,L为红褐色沉淀,则L为Fe(OH)3,D为NaOH,以此逆推可知J为Fe2(SO4)3,G为FeO,则B中含有Fe元素,C为Cl2,B为有机酸盐,则一定含有C、O两元素,E、F为氧化物,结合框图,则F为CO,E为CO2,I为Na2CO3(纯碱),K为NaHCO3(小苏打),
(1)由以上分析可知B加热分解可生成CO、CO2、FeO,则应含有Fe、C、O三种元素,故答案为:Fe、C、O;
(2)I为Na2CO3(纯碱),K为NaHCO3(小苏打),Na2CO3易生成CaCO3,为白色沉淀,可加入CaCl2溶液鉴别,出现白色沉淀者为Na2CO3,
故答案为:取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I;
(3)G→J的反应为FeO生成Fe2(SO4)3的过程,H2O2具有氧化性,反应的离子方程式为2FeO+H2O2+6H+=2Fe3++4H2O,
故答案为:2FeO+H2O2+6H+=2Fe3++4H2O;
(4)H、L、D分别为:NaClO、Fe(OH)3、NaOH,根据物质的量之比为3:2:4,结合生成一种含氧酸盐M,可确定M的化学式为Na2FeO4,方程式为3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O,
故答案为:Na2FeO4.
(1)由以上分析可知B加热分解可生成CO、CO2、FeO,则应含有Fe、C、O三种元素,故答案为:Fe、C、O;
(2)I为Na2CO3(纯碱),K为NaHCO3(小苏打),Na2CO3易生成CaCO3,为白色沉淀,可加入CaCl2溶液鉴别,出现白色沉淀者为Na2CO3,
故答案为:取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I;
(3)G→J的反应为FeO生成Fe2(SO4)3的过程,H2O2具有氧化性,反应的离子方程式为2FeO+H2O2+6H+=2Fe3++4H2O,
故答案为:2FeO+H2O2+6H+=2Fe3++4H2O;
(4)H、L、D分别为:NaClO、Fe(OH)3、NaOH,根据物质的量之比为3:2:4,结合生成一种含氧酸盐M,可确定M的化学式为Na2FeO4,方程式为3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O,
故答案为:Na2FeO4.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,为高考常见题型,本题结合生产生活实际,以解决化学实际问题作思路进行设问,使问题情境真实,充分体现化学与STSE的关系,还化学以本色,能培养学生理论联系实际,学以致用的学习观;试题考查的知识点多,也非常灵活,思维容量较大,题目对化学知识的理解和应用知识能力解决化工生产中有关问题的迁移推理能力要求较高,做题时注意把握化学反应遵循质量守恒定律,以此书写有关的化学方程式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目