题目内容
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是( )
| A、Fe(NO3)x中的x为2 |
| B、稀HNO3在反应中只表现氧化性 |
| C、磁性氧化铁中的所有铁元素全部被氧化 |
| D、反应中每还原0.3mol氧化剂,就有0.9mol电子转移 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A、根据氮元素守恒计算Fe(NO3)x中的x的值;
B、反应中生成硝酸盐和N0,所以硝酸在反应中起氧化剂与酸的作用;
C、磁性氧化铁中的铁元素化合价为+2、+3价,只有部分被氧化;
D、反应中只有氮元素被还原,根据NO计算转移电子.
B、反应中生成硝酸盐和N0,所以硝酸在反应中起氧化剂与酸的作用;
C、磁性氧化铁中的铁元素化合价为+2、+3价,只有部分被氧化;
D、反应中只有氮元素被还原,根据NO计算转移电子.
解答:
解:A、根据氮元素守恒,则9x+1=28,解得x=3,故A错误;
B、反应中生成硝酸盐Fe(NO3)3和N0,所以硝酸在反应中起氧化剂与酸的作用,故B错误;
C、反应中生成硝酸盐Fe(NO3)3,磁性氧化铁中的铁元素化合价为+2、+3价,只有部分铁元素被氧化,故C错误;
D、反应中只有氮元素被还原,氮元素化合价由+5价降低为+2,还原产物为NO,所以生成0.3molNO转移电子为0.3mol×(5-2)=0.9mol,故D正确.
故选D.
B、反应中生成硝酸盐Fe(NO3)3和N0,所以硝酸在反应中起氧化剂与酸的作用,故B错误;
C、反应中生成硝酸盐Fe(NO3)3,磁性氧化铁中的铁元素化合价为+2、+3价,只有部分铁元素被氧化,故C错误;
D、反应中只有氮元素被还原,氮元素化合价由+5价降低为+2,还原产物为NO,所以生成0.3molNO转移电子为0.3mol×(5-2)=0.9mol,故D正确.
故选D.
点评:本题考查氧化还原反应基本概念与计算,难度不大,C选项清楚磁性氧化铁中铁元素化合价是关键,注意守恒思想的应用.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
下列关于电解质溶液的叙述中正确的是( )
| A、Na2CO3、NaHCO3两种盐的溶液中,离子种类不相同 |
| B、常温下1mol?L-1的CH3COOH溶液与1mol?L-1的NaOH溶液等体积混合,所得混合液中[Na+]>[CH3COO-]>[H+]>[OH-] |
| C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,[NH4+]前者小于后者 |
| D、常温下,某溶液中由水电离出的[H+]为1.0×10-5mol?L-1,则此溶液可能是盐酸,也可能是NH4Cl溶液 |
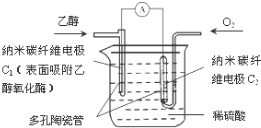 生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示.已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+.下列说法不正确的是( )
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示.已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+.下列说法不正确的是( )| A、C1极为电池负极,C2极为电池正极 |
| B、C2极的电极反应式为O2+4H++4e-=2H2O |
| C、该生物燃料电池的总反应方程式为C2H5OH+3O2=2CO2+3H2O |
| D、电池放电过程中电解质溶液的pH不变 |
近日,包括合肥在内的大多城市发生持续雾霾天气,PM2.5数据监测受到了重视.PM2.5是指大气中直径小于2.5微米(1微米=10-6米)的可吸入肺的有害颗粒.下列说法不正确的是( )
| A、PM2.5主要来自工业生产,汽车尾气排放等过程中产生的残留物 |
| B、PM2.5表面积大,能吸附大量有害物质 |
| C、研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染 |
| D、我们要提倡先改善人们的生活质量,随着科技的发展再进行污染的治理 |
把铁放入盛有盐酸的试管中,不影响氢气产生速率的是( )
| A、盐酸的浓度 |
| B、用铁粉代替铁片 |
| C、增大压强 |
| D、溶液的温度 |
将3.48g Fe3O4完全溶解在100mL 1mol?L-1硫酸中,然后加入一定体积的0.1mol?L-1的K2Cr2O7溶液,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-全部还原为Cr3+,则加入K2Cr2O7溶液的体积为( )
| A、15mL | B、25mL |
| C、35mL | D、50mL |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为29.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A、R位于元素周期表中第二周期第ⅣA族 |
| B、五种元素中原子半径最大的是X |
| C、气态氢化物稳定性:Y>T |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
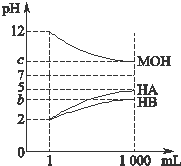 为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:
为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题: