题目内容
18.12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为62g/mol,该物质的化学式为Na2O.分析 12.4克Na2X中含有0.4molNa+,根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量,根据Na2X相对原子质量来确定分子式.
解答 解:12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=$\frac{1}{2}$n(Na+)=0.4mol×$\frac{1}{2}$=0.2mol,
Na2X的摩尔质量为:M(Na2X)=$\frac{12.4g}{0.2mol}$=62g/mol;
摩尔质量在数值上等于其相对分子质量,即Na2X的相对原子量为62;
钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16;
X为氧原子,该物质的化学式为Na2O,
故答案为:62g/mol;Na2O.
点评 本题主要考查物质的量的计算,题目难度不大,注意质量守恒定律、摩尔质量在数值上等于其相对分子质量等概念的运用,试题侧重对学生能力的培养和解题方法的指导和训练.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
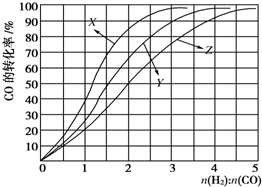
9.在一容积可变的密闭容器中,通入1mol X和3mol Y,在一定条件下发生如下反应:X(g)+3Y(g)?2Z(g),到达平衡后,Y的体积分数为a%,然后再向容器中通入2mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b%.则a与b的关系是( )
| A. | a=b | B. | a>b | C. | a<b | D. | 不能确定 |
6.下列关于胶体的叙述不正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间 | |
| B. | 胶体是一种均一、稳定的纯净物 | |
| C. | 用平行光照射CuSO4溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | Al(OH)3胶体能够吸附水中悬浮的固体颗粒沉降,达到净水目的 |
3.下列说法中不正确的是( )
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| C. | 为了防止龋齿,人人都要长期吃口香糖 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
7.下列叙述中正确的是( )
| A. | 酸碱中和滴定时眼睛要注视着滴定管内液面的变化,以防止滴定过量 | |
| B. | 在海轮外壳上绑上锌块,可减缓外壳腐蚀,这是应用外加电流的阴极保护法来防腐 | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式为:2H2O (l)═2H2(g)+O(g△H=571.6kJ/mol | |
| D. | 增大反应物浓度,使活化分子百分数增加,化学反应速率增大 |
8.铟产业被称为“信息时代的朝阳产业”.元素周期表中铟的数据如图,下列说法完全正确的是( )
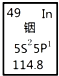

| A. | 铟元素的质量数是114.8 | B. | 铟元素的相对原子质量是114 | ||
| C. | 铟元素是一种副族元素 | D. | 铟原子最外层有3个电子 |
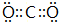 .
.