题目内容
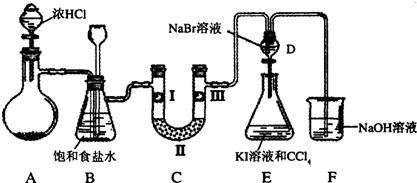
19.溴及其化合物广泛应用于有机合成、化学分析等领域.海水提溴过程中溴元素的变化如图: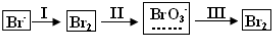
(1)过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气,生成Br2.Cl2氧化Br-应在酸性条件下进行,目的是避免Cl2(或Br2)发生歧化(或自身氧化还原)反应. 调节海水pH可提高Cl2的利用率,用平衡原理解释其原因是通入后发生反应Cl2+H2O=Cl-+H++HClO,增大c(H+),平衡逆向移动,抑制Cl2与水反应.
(2)过程Ⅱ,用热空气可将溴吹出,其原因是溴易挥发;再用浓碳酸钠溶液吸收.完成并配平下列方程式.
3Br2+3Na2CO3→1NaBrO3+3CO2+5NaBr
(3)过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液.相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是盐酸有还原性,与溴酸根反应.
(4)NaBrO3是一种分析试剂.向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO3- |
| 物质的量/mol | 0.5 | 1.3 |
分析 (1)海水显碱性,调其pH<3.5后,再通入氯气,生成Br2.Cl2氧化Br-应在酸性条件下进行,目的是避免Cl2(或Br2)在碱性条件下发生歧化(或自身氧化还原)反应. 调节海水pH可提高Cl2的利用率,原因是通入后发生反应Cl2+H2O→Cl-+H++HClO,增大c(H+),平衡逆向移动,抑制Cl2与水反应;
(2)过程II,用热空气可将溴吹出,其原因是溴的挥发性;再用浓碳酸钠溶液吸收.根据氧化还原反应得失电子守恒即可配平;
(3)过程III中用硫酸酸化可得Br2和Na2SO4的混合溶液.相同条件下,若用盐酸酸化,由于溴酸根具有氧化性,氯离子具有还原性,发生氧化还原反应,导致一部分溴反应掉,则所得溴的质量减少;
(4)根据离子反应情况以及电子守恒来计算.
解答 解:(1)海水显碱性,调其pH<3.5后,再通入氯气,生成Br2.Cl2氧化Br-应在酸性条件下进行,目的是避免Cl2(或Br2)在碱性条件下发生歧化(或自身氧化还原)反应. 调节海水pH可提高Cl2的利用率,原因是通入后发生反应Cl2+H2O→Cl-+H++HClO,增大c(H+),平衡逆向移动,抑制Cl2与水反应,
故答案为:酸性;Cl2(或Br2)发生歧化(或自身氧化还原)反应;Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应;
(2)过程II,用热空气可将溴吹出,其原因是溴的挥发性;再用浓碳酸钠溶液吸收,反应的方程式为3Br2+3Na2CO3→1NaBrO3+3CO2+5NaBr,
故答案为:溴易挥发(或沸点低); 3; 3; 1;3; 5NaBr;
(3)过程III中用硫酸酸化可得Br2和Na2SO4的混合溶液.相同条件下,若用盐酸酸化,由于溴酸根具有氧化性,氯离子具有还原性,发生氧化还原反应,导致一部分溴反应掉,则所得溴的质量减少,故答案为:盐酸有还原性,与溴酸根反应;
(4)2.6mol NaBrO3反应生成溴单质时转移的电子数为2.6×5=13mol,生成碘为0.5mol,转移的电子为1mol,则生成IO3-转移的电子数为12mol,生成IO3-的物质的量为2mol,根据碘原子守恒,则原溶液中NaI的物质的量为2+1=3mol,
故答案为:3.
点评 本题以卤族元素的性质考查为载体,综合考查元素化合物知识,为高频考点,侧重于注重氧化还原反应的考查,注意电子守恒思想的灵活应用是解体的关键,难度大.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 常温常压下,22.4L氧气含分子数为NA个O2 | |
| B. | 1molNa2O2化合物中有2mol阴离子和2mol阳离子 | |
| C. | 2.3g金属钠变为钠离子失去电子数为0.1NA | |
| D. | .常温下,1 L 0.5 mol•L-1 NH4Cl溶液中含有3.01×1023个NH4+ |
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 橄榄石中铁为+2价 | |
| C. | 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | |
| D. | 斜长石的氧化物形式可表示为:K2O•Al2O3•3SiO2 |
| A. | 0.96 g | B. | 2.88 g | C. | 4.32 g | D. | 5.76 g |
①在高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃气体;
②在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到钛.
下列说法不正确的是( )
| A. | 反应①、②均为氧化还原反应 | |
| B. | 在反应①中金红石和焦炭均为还原剂 | |
| C. | 反应①中可燃性气体是CO | |
| D. | 反应②中有1molTi生成时,转移4mol e- |
| A. | 用SO2漂白食品 | B. | 用硅制作太阳能电池 | ||
| C. | 工业上用氮气和氢气合成氨 | D. | 漂白粉可用于杀菌消毒 |
| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | NO气体遇空气由无色变为红棕色 | |
| C. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |