题目内容
13.下列电离方程式,不正确的是( )| A. | KOH═K++OH- | B. | NaHCO3?Na++HCO3- | ||
| C. | NH3•H2O?NH4++OH- | D. | CH3COOH?CH3COO-+H+ |
分析 A.氢氧化钾为强碱,属于强电解质,完全电离;
B.碳酸氢钠属于盐,是强电解质,完全电离应等号;
C.一水合氨为弱碱,属于弱电解质,部分电离,用可逆号;
D.醋酸为弱酸,属于弱电解质,部分电离,用可逆号.
解答 解:A.氢氧化钾为强碱,属于强电解质,完全电离,电离方程式:KOH═K++OH-,故A正确;
B.碳酸氢钠属于盐,是强电解质,电离方程式:NaHCO3?=Na++HCO3-,故B错误;
C.一水合氨为弱碱,属于弱电解质,电离方程式:NH3•H2O?NH4++OH-,故C正确;
D.醋酸为弱酸,属于弱电解质,电离方程式:CH3COOH?CH3COO-+H+,故D正确;
故选:B.
点评 本题主要考查学生电离方程式的书写知识,明确电解质的强弱及电离方程式书写方法是解题关键,注意原子团不能拆.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
1.下列说法错误的是( )
| A. | Fe与S混合加热生成FeS | |
| B. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 | |
| C. | 检验SO2气体中是否含有CO2气体,可将气体先通入饱和碳酸氢钠溶液,再通入品红溶液,最后通入澄清石灰水溶液 | |
| D. | 氯化氢水溶液能导电,所以氯化氢是电解质 |
8.下列物质间的转化,能经过一步化合反应直接转化的是( )
| A. | SiO2→H2SiO3 | B. | Na2O2→Na2CO3 | C. | Fe→FeCl2 | D. | Al2O3→Al(OH)3 |
2.已知氟化氢气体中有平衡关系:
2H3F3(g)?3H2F2(g)△H1=a kJ•mol-1
H2F2 (g)?2HF (g)△H2=b kJ•mol-1
已知a、b均大于0;则可推测反应:H3F3(g)?3HF(g)的△H3为( )
2H3F3(g)?3H2F2(g)△H1=a kJ•mol-1
H2F2 (g)?2HF (g)△H2=b kJ•mol-1
已知a、b均大于0;则可推测反应:H3F3(g)?3HF(g)的△H3为( )
| A. | +(a+b)kJ•mol-1 | B. | +(a-b)kJ•mol-1 | ||
| C. | +(a+3b)kJ•mol-1 | D. | +(0.5a+1.5b)kJ•mol-1 |
 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.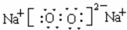 .
.

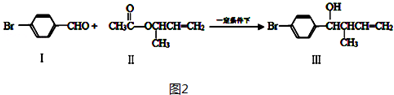
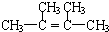
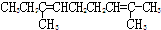 .
.