题目内容
4.X、Y、Z、R、W为前四周期元素且原子序数依次增大.Y和R同主族;X、R原子中未成对电子数之比为3:2;Z与Y可以形成两种原子个数比分别为1:1和2:1固态化合物;W 3+中有5个未成对电子.请回答下列问题:
(1)写出Z和Y原子个数比为1:1的化合物的电子式
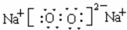 .
.(2)W基态原子的核外电子排布式是1s22s22p63s23p63d63s2.
(3)X、Y、R原子的第一电离能从小到大的关系为(用元素符号,下同)S<O<N,
(4)与X的气态氢化物互为等电子体的分子、离子有PH3、H3O+(各举一例)
(5)W单质与足量的Y单质在点燃条件下充分发生反应,生成一种黑色固体.为了确定该固体的组成,先将固体溶于足量稀硫酸中,向所得溶液中分别滴入下列试剂即可,符合试剂是CD.(代号填空)
A.氯水 B.NaOH溶液 C.KSCN溶液 D.KMnO4溶液
(6)W的一种含氧酸根WO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是4FeO42-+20 H+=4Fe3++3O2↑+10H2O.
(7)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在.已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为$\frac{\sqrt{3}(1+a)}{(1+b)}$.
分析 X、Y、Z、R、W为前四周期元素且原子序数依次增大.Z与Y可以形成两种原子个数比分别为1:1和2:1固态化合物,则Z为钠元素,Y为氧元素;Y和R同主族,则R为硫元素;X、R原子中未成对电子数之比为3:2,则X为氮元素,W3+中有5个未成对电子,只能处于第四周期,则W为铁元素,据此答题.
(1)Z和Y原子个数比为1:1的化合物为过氧化钠,由钠离子与过氧根离子构成;
(2)W为铁元素,26号元素,原子核外有26个电子,根据能量最低原理书写;
(3)氮原子中2p能级容纳3个电子,为半充满状态,能量较低,第一电离能高于相邻的同周期元素,O、S同主族,自上而下第一电离能减小;
(4)原子总数相同、价电子总数相同的微粒互为等电子体;
(5)Fe单质与足量的氧气在点燃条件下充分发生反应,生成一种黑色固体可能为FeO、Fe3O4或二者混合物,先将固体溶于足量稀硫酸中,因为所得溶液中有铁离子和亚铁离子,可以通过KSCN溶液呈血红色来检验铁离子的存在,通过KMnO4溶液能褪色证明亚铁离子的存在;
(6)含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,有Fe3+生成,并有无色气体产生,结合电子转移守恒可知,只有氧元素被氧化,故该无色气体为O2;
(7)设Cl-的半径为1,则Na+半径为a,Cs+半径为b,氯化钠的晶胞结构如图所示 ,晶胞的边长为2(1+a);氯化铯的晶胞结构为
,晶胞的边长为2(1+a);氯化铯的晶胞结构为 ,晶胞的体对角线长度为2(1+b),则晶胞的边长为$\frac{\sqrt{3}}{3}$×2(1+b.
,晶胞的体对角线长度为2(1+b),则晶胞的边长为$\frac{\sqrt{3}}{3}$×2(1+b.
解答 解:X、Y、Z、R、W为前四周期元素且原子序数依次增大.Z与Y可以形成两种原子个数比分别为1:1和2:1固态化合物,则Z为钠元素,Y为氧元素;Y和R同主族,则R为硫元素;X、R原子中未成对电子数之比为3:2,则X为氮元素,W3+中有5个未成对电子,只能处于第四周期,则W为铁元素.
(1)Z和Y原子个数比为1:1的化合物为过氧化钠,它的电子式为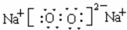 ,
,
故答案为: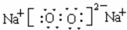 ;
;
(2)W为铁元素,26号元素,它的基态原子的核外电子排布式是 1s22s22p63s23p63d63s2,
故答案为:1s22s22p63s23p63d63s2;
(3)氮原子中2p能级容纳3个电子,为半充满状态,能量较低,所以氮的第一电离能高于相邻的同周期元素,O、S同主族,自上而下第一电离能减小,故第一电离能从小到大的关系为:S<O<N,
故答案为:S<O<N;
(4)原子总数相同、价电子总数相同的微粒互为等电子体,与NH3互为等电子体的分子PH3 等、离子有H3O+或等,
故案为:PH3;H3O+;
(5)Fe单质与足量的氧气在点燃条件下充分发生反应,生成一种黑色固体可能为FeO、Fe3O4或二者混合物,为了确定该固体的组成,先将固体溶于足量稀硫酸中,因为所得溶液中有铁离子和亚铁离子,可以通过KSCN溶液呈血红色来检验铁离子的存在,通过KMnO4溶液能褪色,证明亚铁离子的存在,
故答案为:CD;
(6)含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,有Fe3+生成,并有无色气体产生,结合电子转移守恒可知,只有氧元素被氧化,故该无色气体为O2,反应离子方程式为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O,
故答案为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O;
(7)设Cl-的半径为1,则Na+半径为a,Cs+半径为b,氯化钠的晶胞结构如图所示 ,晶胞的边长为2(1+a);氯化铯的晶胞结构为
,晶胞的边长为2(1+a);氯化铯的晶胞结构为 ,晶胞的体对角线长度为2(1+b),则晶胞的边长为$\frac{\sqrt{3}}{3}$×2(1+b),所以氯化钠与氯化铯的晶胞边长比为2(1+a):$\frac{\sqrt{3}}{3}$×2(1+b)=$\frac{\sqrt{3}(1+a)}{(1+b)}$,
,晶胞的体对角线长度为2(1+b),则晶胞的边长为$\frac{\sqrt{3}}{3}$×2(1+b),所以氯化钠与氯化铯的晶胞边长比为2(1+a):$\frac{\sqrt{3}}{3}$×2(1+b)=$\frac{\sqrt{3}(1+a)}{(1+b)}$,
故答案为:$\frac{\sqrt{3}(1+a)}{(1+b)}$.
点评 本题是对物质结构的考查,涉及电子式、原子核外电子排布、等电子体、元素周期律、实验方案的设计、晶胞计算等,具有一定的综合性,解题的关键是元素的推断,注意识记中学常见的晶胞结构,中等难度.

| A. | 该反应中旧键断裂需吸收能量小于新键形成需放出能量 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量无关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 反应物的总能量高于生成物的总能量 |
| A. | 氧化钙和铁粉常用作食品干燥剂 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 碳酸钡不溶于水因此在医疗上用作钡餐 | |
| D. | “血液透析”利用了胶体的性质 |
 一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| C. | 充电时镍电极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
| A. | NH4Cl+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+H2O+NH3↑ | B. | 2H2S+O2═2H2O+2S↓ | ||
| C. | NaH+H2O═NaOH+H2↑ | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
| A. | KOH═K++OH- | B. | NaHCO3?Na++HCO3- | ||
| C. | NH3•H2O?NH4++OH- | D. | CH3COOH?CH3COO-+H+ |
| A. | 在pH=1溶液中:NH4+、K+、HS-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 使酚酞试液变红的溶液中:Na+、Cl-、SO${\;}_{4}^{2-}$、Fe3+ | |
| D. | 无色透明的水溶液中:K+、Ba2+、I-、NO${\;}_{3}^{-}$ |