题目内容
关于1mol的CO2,下列结论不正确的是( )
| A、1mol的CO2约含6.02×1023 个CO2分子 | B、1mol的CO2的质量为44g | C、1mol的CO2体积约为22.4L | D、1mol的CO2含有2mol的氧原子 |
分析:A.结合N=nNA计算;
B.结合m=nM计算;
C.标况下,Vm=22.4L/mol;
D.结合分子的构成解答.
B.结合m=nM计算;
C.标况下,Vm=22.4L/mol;
D.结合分子的构成解答.
解答:解:A.1mol的CO2约含1mol×NAmol-1=6.02×1023 个CO2分子,故A正确;
B.1mol的CO2的质量为1mol×44g/mol=44g,故B正确;
C.标况下,Vm=22.4L/mol,状况未知,不能计算气体的体积,故C错误;
D.1个分子中含2个O原子,则1mol的CO2含有2mol的氧原子,故D正确;
故选C.
B.1mol的CO2的质量为1mol×44g/mol=44g,故B正确;
C.标况下,Vm=22.4L/mol,状况未知,不能计算气体的体积,故C错误;
D.1个分子中含2个O原子,则1mol的CO2含有2mol的氧原子,故D正确;
故选C.
点评:本题考查物质的量的有关计算,把握质量、体积、微粒数、物质的量的关系为解答的关键,注意选项C中Vm与状况有关,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
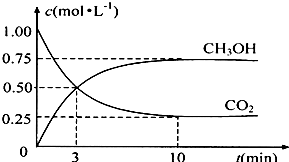
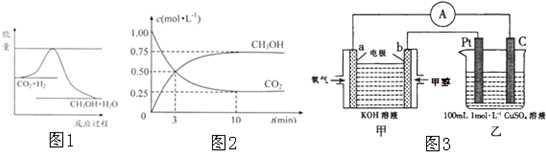
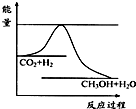 温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.