��Ŀ����
13��NH3��һϵ�з�Ӧ���Եõ�HNO3��NH4NO3����ͼ1��ʾ����1��I�У�NH3��O2�ڴ��������·�Ӧ���仯ѧ����ʽ��4NH3+5O2$\frac{\underline{\;����\;}}{��}$4NO+6H2O��
��2��II�У�2NO��g��+O2��g��?2NO2��g������ʼʱ��������1molNO��0.5molO2���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ��p1��p2�������¶ȱ仯�����ߣ���ͼ2����
�ٱȽ�p1��p2�Ĵ�С��ϵp2��p1��
�����¶�Ϊ500�桢ѹǿΪp2�����£�ƽ��������NO2���������50%��

��3��III�У���NO2��g��ת����N2O4��l�������Ʊ�Ũ���ᣮ
����֪��2NO2��g��?N2O4��g����H1 2NO2��g��?N2O4��l����H2
��ͼ3��Ӧ�����������仯��ȷ����A������ţ���
��N2O4��O2��H2O���ϵĻ�ѧ����ʽ2N2O4+O2+2H2O=4HNO3��
��4��IV�У����NO�Ʊ�NH4NO3���乤��ԭ����ͼ4��ʾ
�������ĵ缫��ӦʽNO-3e-+2H2O=NO3-+4H+�������ĵ缫��ӦʽNO+5e-+5H2O=NH3•H2O+5OH-��
�ڵ��һ��ʱ����������Һ�����ԣ����ԡ����Ի����ԣ���Ϊʹ������ȫ��ת��ΪNH4NO3���貹������A��A��NH3��
���� ��1����������������һ��������ˮ��
��2���ٷ�Ӧ2NO��g��+O2��g��?2N02��g��������Ӧ�����������С�ķ�Ӧ������ѹǿƽ��������Ӧ�����ƶ���ƽ��ʱNO��ת��������
������500�桢ѹǿΪp2�����£�NO��ת����Ϊ60%������
��3���ٽ����¶ȣ���NO2��g��ת��ΪN2O4��l��˵����Ӧ2NO2��g��?N2O4��l��Ϊ���ȷ�Ӧ��ͬ������Һ̬ʱ��������̬ʱ�����ͣ�
��N2O4��O2��H2O�����������ᣬ���ݵ�ʧ�����غ��ԭ���غ�д����Ӧ�ķ���ʽ��
��4���ٹ�ҵ�ϵ��NO�Ʊ� NH4NO3����װ��ͼ��֪��������������Ӧ��NO����������NO3-������������ԭ��Ӧ��NO����ԭ����NH4+��������ӦΪNO-3e-+2H2O=NO3-+4H+��������ӦΪ��NO+5e-+6H+=NH4++H2O��
�����ݵ�ⷽ��ʽ�жϽ��
��� �⣺��1����������������һ��������ˮ����ѧ����ʽ��4NH3+5O2$\frac{\underline{\;����\;}}{��}$4NO+6H2O��
�ʴ�Ϊ��4NH3+5O2$\frac{\underline{\;����\;}}{��}$4NO+6H2O��
��2���ٷ�Ӧ2NO��g��+O2��g��?2N02��g��������Ӧ�����������С�ķ�Ӧ������ѹǿƽ��������Ӧ�����ƶ���ƽ��ʱNO��ת����������ͼ��֪P2ʱNO��ת���ʴ���P2ʱѹǿ��P1��P2��
�ʴ�Ϊ��P1��P2��
��500�桢ѹǿΪp2�����£�NO��ת����Ϊ60%��
2NO��g��+O2��g��?2NO2��g��
��ʼ��mol 1 0.5 0
ת����mol 1��60%=0.6 0.3 0.6
ƽ����mol 0.4 0.2 0.6
�������������������$\frac{0.6mol}{1.2mol}$��100%=50%��
�ʴ�Ϊ��50%��
��3���ٽ����¶Ƚ�NO2��g��ת��ΪN2O4��l����˵����Ӧ2NO2��g��?N2O4��l��Ϊ���ȷ�Ӧ��������ͼ���и÷�Ӧ�ķ�Ӧ�������������������������ߣ�ͬ��������̬��Һ̬��ų���������N2O4��l�����е�������N2O4��g�����е������ͣ�ͼ��A���ϣ�
�ʴ�Ϊ��A��
��N2O4��O2��H2O�����������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ��2N2O4+O2+2H2O=4HNO3��
�ʴ�Ϊ��2N2O4+O2+2H2O=4HNO3��
��4���ٵ��NO�Ʊ�NH4NO3��������ӦΪNO-3e-+2H2O=NO3-+4H+��������ӦΪ��NO+5e-+6H+=NH4++H2O��
�ʴ�Ϊ��NO-3e-+2H2O=NO3-+4H+��NO+5e-+5H2O=NH3•H2O+5OH-��
�ڵ��NO�Ʊ�NH4NO3��������ӦΪ5NO-15e-+10H2O=5NO3-+20 H+��������ӦΪ��3NO+15e-+18H+=3NH4++3H2O���ܷ�Ӧ����ʽΪ��8NO+7H2O$\frac{\underline{\;���\;}}{\;}$3NH4NO3+2HNO3�������Ҫʹ������ȫ��ת��ΪNH4NO3���貹��NH3����Ӧ����������Һ�����ԣ�
�ʴ�Ϊ�����ԣ�NH3��
���� ���ʵ���Ũ����ʱ��仯������Ӧ���ʼ��㡢��ѧƽ��ͼ��Ӱ�����ء�ƽ�ⳣ��Ӱ�����ء������仯ͼ���ԭ���ȣ���Ŀ�Ѷ��еȣ���Ϥ���֪ʶ�ǽ���ؼ���

 ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�| A�� | �ڷŵ�ʱ���õ�صĸ���������Ǧ�� | |
| B�� | �ڳ��ʱ��Ǧ���صĸ�����������Դ�ĸ������� | |
| C�� | �ڷŵ�ʱ�����·�е�������Ϊ�����������·������ | |
| D�� | �ڳ��ʱ�����������ķ�ӦΪ��PbSO4+2e-�TPb+SO${\;}_{4}^{2-}$ |
| A�� | +1 | B�� | +2 | C�� | +3 | D�� | +4 |
| A�� | CaCl2�ĵ��뷽��ʽ��CaCl2�TCa2++2Cl- | |
| B�� | �Ҵ��Ľṹ��ʽ��C2H6O | |
| C�� | ����ԭ�ӽṹʾ��ͼ�� | |
| D�� | ������ĵ���ʽ�� |
| A�� | ���۹��塢Һ�廹�������ȼ�շ�Ӧ�����ǡ�H��O | |
| B�� | ���ȷ�Ӧ���淴Ӧһ���Ƿ��ȷ�Ӧ | |
| C�� | ̼����ȫȼ��ʱ������CO2�ų��������Ȳ���ȫȼ������CO�ų��������� | |
| D�� | H2��һ���������ɫ��Դ������Ϊȼ��1molH2���ų��������ر�� |
| A�� | �����������Ͽ�й©���ĸ�Ũ����������������Һ | |
| B�� | ��������й©ʱ��������Ա���ý���̼������Һ��ë����ס�ǿ������ұ��� | |
| C�� | �����ܸ�ʴ�������ǽ������ϣ����ָ�ʴ��Ҫ���ڵ绯ѧ��ʴ | |
| D�� | ���Ȼ��������Ǽ��Է��� |
| A�� | �ṹʽ��H2-C=C-H2 | B�� | ���ʽ��CH2 | ||
| C�� | ����ʽ��C2H4 | D�� | ����ʽ�� |
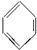 $��_{��}^{H_{2}SO_{4}��SO_{3}���������ᣩ}$
$��_{��}^{H_{2}SO_{4}��SO_{3}���������ᣩ}$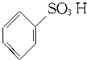
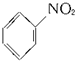 $\stackrel{Fe��HCl��H_{2}O}{��}$
$\stackrel{Fe��HCl��H_{2}O}{��}$
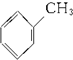 $\stackrel{NaClO}{��}$
$\stackrel{NaClO}{��}$

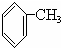 C
C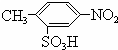 D
D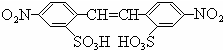 ��
��