��Ŀ����
��������������������������������Ľ��죬�о���ѧ��Ӧ���������仯�Ժ������ó�����Դ�Ϳ�������Դ����ʮ����Ҫ�����塣����˵���в���ȷ����
| A���κλ�ѧ��Ӧ�������������ı仯 |
| B����ѧ��Ӧ�е������仯������Ϊ�����ı仯 |
| C����Ӧ������������������������������Ӧ�ͷ����� |
| D������ѧ���γ�ʱ�ͷŵ�����С�ھɻ�ѧ�����ƻ�ʱ��Ҫ���յ���������Ӧ�������� |
B
���������������ѧ��Ӧ��ʵ���Ǿɼ������¼��γɣ��ϼ���Ҫ�����������ɼ��ͷ�����������κλ�ѧ��Ӧ�����������仯������ѧ���γ�ʱ�ͷŵ�����С�ھɻ�ѧ�����ƻ�ʱ��Ҫ���յ���������Ӧ������������A��D��ȷ����ѧ��Ӧ�������仯�������⣬���ɱ���Ϊ���ܡ����ܵȣ�B����Ӧ������������������������������Ӧ�ͷ�������C��ȷ��
���㣺���黯ѧ��Ӧ�������仯��

��֪��H(g) + H(g) �� H2(g) ��H����435.7kJ/mol�����Ȼ�ѧ����ʽ������������
| A����ԭ�ӵ�����������ӵ������� |
| B��������ԭ�ӽ�ϳ�һ�������ʱ�ų�435.7kJ���� |
| C��1mol����ӷֽ��2mol��ԭ��Ҫ����435.7kJ���� |
| D��2mol��ԭ�ӽ��1mol����ӳ�Ҫ����435.7kJ���� |
����кͷ�Ӧ NaOH��?��+ HCl��?����NaCl��?��+ H2O(?)+57.6 kJ��,�ʺű�ʾ��״̬��ȷ����
| A��NaOH���� | B�����Һ | C��NaCl����Һ | D��H2O����Һ |
��֪��C(s)��H2O(g)��CO(g)��H2(g) ��H��a kJ/mol
C(s)��O2(g)��2CO(g) ��H����220 kJ/mol
H��H��O��O��O��H���ļ��ֱܷ�Ϊ436��496��462 kJ/mol����aΪ
| A����332 | B����118 | C����350 | D����130 |
��֪��
2CO(g)��O2(g)===2CO2(g)����H����566 kJ��mol��1
Na2O2(s)��CO2(g)===Na2CO3(s)�� O2(g) ��H����266 kJ��mol��1
O2(g) ��H����266 kJ��mol��1
���������Ȼ�ѧ����ʽ�жϣ�����˵����ȷ����
| A��CO��ȼ����Ϊ283 kJ |
| B����ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ |
| C��2Na2O2(s)��2CO2(s)===2Na2CO3(s)��O2(g)����H>��532kJ��mol��1 |
| D��CO(g)��Na2O2(s)��Ӧ�ų�549 kJ����ʱ������ת����Ϊ6��02��1023 |

��֪��C(s)��O2(g)��CO2(g) ��H1
CO2(g)��C(s)��2CO(g) ��H2
2CO(g)��O2(g)��2CO2(g) ��H3
4Fe(s)��3O3(g)��2Fe2O3(s) ��H4
3 CO(g)��Fe2O3(s)��3CO2(g)��2Fe(s) ��H5
���й���������Ӧ�ʱ���ж���ȷ����
| A����H1��0����H3��0 |
| B����H2��0����H4��0 |
| C����H1����H2����H3 |
| D����H3����H4����H5 |
��6�֣���2012?���죩�£�H2N��NH2����һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol��ѧ�������������kJ����N��NΪ942��O=OΪ500��N��NΪ154�������1molN��H�������������kJ���ǣ� ��
| A��194 | B��391 | C��516 | D��658 |
��ԭ�Ӷ�O3�ķֽ��д����ã�O3��Cl��ClO��O2����H1��ClO��O��Cl��O2����H2������������ķֽⷴӦ�ǣ�O3��O��2O2����H���÷�Ӧ�������仯��ͼ��ʾ��������������ȷ����(����)��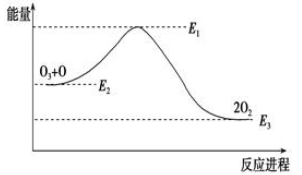
�ٷ�ӦO3��O��2O2�Ħ�H��E1��E3���ڷ�ӦO3��O��2O2�Ƿ��ȷ�Ӧ���ۦ�H����H1����H2���ܴ������еij���������
| A���٢� | B���ڢ� | C���ۢ� | D���ڢ� |
SF6��һ�������ľ�Ե���壬���ӽṹ��ֻ����S-F������֪��1molS(s)ת��Ϊ��̬��ԭ����������280kJ,����1molF-F ��S-F�������յ������ֱ�Ϊ160kJ��330kJ����S(s)��3F2(g)=SF6(g)�ķ�Ӧ�ȡ�HΪ
| A����1780kJ/mol | B����1220 kJ/mol | C����450 kJ/mol | D����430 kJ/mol |