题目内容
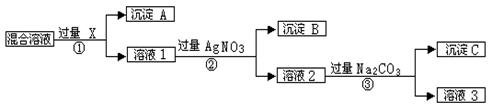
(10分)为了除去NaCl溶液中少量的MgCl2、Na2SO4,从稀盐酸,Na2CO3,K2CO3,Ba(NO3)2,Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中步骤进行操作:

(1)下列试剂的化学式A C
(2)加入过量A的原因是 ,有关反应的离子方程式是 ,
(3)加入过量B有关反应的离子方程式是 。

(1)下列试剂的化学式A C
(2)加入过量A的原因是 ,有关反应的离子方程式是 ,
(3)加入过量B有关反应的离子方程式是 。
(1)A:Ba(OH)2 C:HCl
(2) 除尽溶液中的Mg2+和 SO42- , Mg2+ + 2OH- = Mg(OH)2↓ Ba2+ + SO42- = BaSO4↓
(3) Ba2+ + CO32-= BaCO3↓
(2) 除尽溶液中的Mg2+和 SO42- , Mg2+ + 2OH- = Mg(OH)2↓ Ba2+ + SO42- = BaSO4↓
(3) Ba2+ + CO32-= BaCO3↓
试题分析:本题实质是除去Mg2+和SO42-。加过量氢氧化钡溶液可同时除去这两种离子,但又引入了Ba2+和OH-,加过量碳酸钠溶液除去Ba2+,加适量盐酸除去OH-和CO32-。
(1)A、B、C分别为氢氧化钡溶液、碳酸钠溶液、盐酸。
(2)加过量氢氧化钡溶液的目的是使Mg2+和SO42-沉淀完全,离子方程式为Mg2+ + 2OH- = Mg(OH)2↓、Ba2+ + SO42- = BaSO4↓。
(3)加入过量碳酸钠溶液的离子方程式为Ba2+ + CO32- = BaCO3↓。
点评:除杂时加入的试剂要过量,过量的试剂在后续的步骤中要除去。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 请回答下列问题:
请回答下列问题: