题目内容
【题目】在溶液中有浓度均为0.01mol·L﹣1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:25℃时,Ksp=4.0×10﹣38;Ksp=7.0×10﹣31,Ksp=1.0×10﹣17;Ksp=1.8×10﹣11.当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小( )
A. Fe3+ B. Cr3+
C. Zn2+ D. Mg2+
【答案】A
【解析】
根据Ksp计算出不同离子形成沉淀所需c(OH-),c(OH-)越小,溶液的pH越小;
根据金属离子的浓度和溶度积常数可以知道,四种离子开始沉淀时的氢氧根离子浓度分别是: ![]() =1.58×10-12molL-1;
=1.58×10-12molL-1;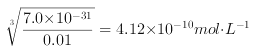 ;
;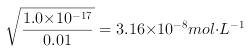 ;
;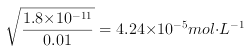 ;故当氢氧化物开始沉淀时,铁离子所需溶液的pH最小;
;故当氢氧化物开始沉淀时,铁离子所需溶液的pH最小;
综上,本题选A。

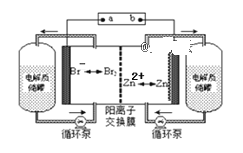
【题目】ClO2是一种易溶于水难溶于有机溶剂的气体,在自来水消毒和果蔬保鲜等方面应用广泛。某同学在实验室中制取ClO2,并探究其性质。回答下列问题:
Ⅰ.ClO2的制备
实验室制备ClO2的反应原理为2NaClO2 + Cl2 = 2ClO2 + 2NaCl,装置如下图所示:
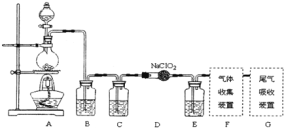
(1)装置A烧瓶中发生反应的离子方程式为___________________________。
(2)装置B中盛放的最佳试剂为________(填字母代号);
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
(3)控制滴加浓盐酸的速率,使产生的气体缓缓通过装置D,其目的是______________________________________________________________。
Ⅱ.探究ClO2的氧化性,按下图所示装置进行实验:
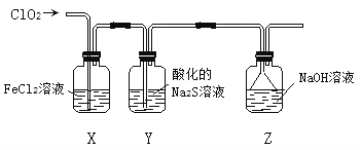
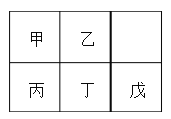
(4)完成下列表格中的空格:
洗气瓶 | 现象或作用 | 解释原因 |
X | 溶液由浅绿色变成棕黄色 | 反应的离子方程式为_________________ |
Y | 溶液中出现淡黄色沉淀 | 反应的离子方程式为______________ |
Z | NaOH溶液的作用是________________________ | 反应的化学方程式为 2NaOH + 2ClO2 = NaClO2 + NaClO3 + H2O |
Ⅲ.测定水中的浓度
用碘量法测定水中ClO2浓度的实验步骤:取100 mL的水样加稀硫酸调节pH至2~3,加入一定量的KI溶液,充分振荡后,再加入几滴指示剂,用2.0×10-4 mol/L标准Na2S2O3溶液进行滴定(已知:2ClO2 + 10I- + 8H+ = 5I2 + 2Cl- + 4H2O ;2S2O32- + I2 = S4O62- + 2I- )。
(5)若达到滴定终点时,消耗15.00 mL 标准Na2S2O3溶液,则水样中ClO2的浓度是 _________ mol/L。